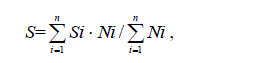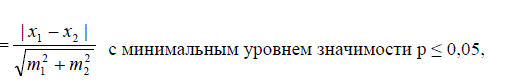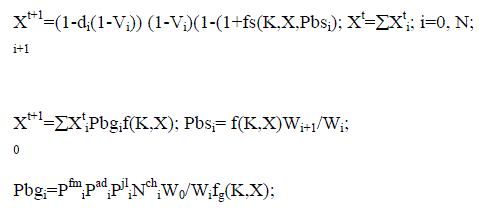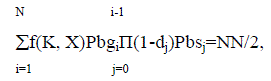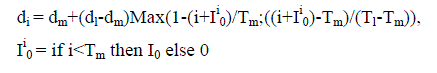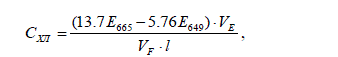Материалы и методы. технологии сохранения редких видов рыб.
Методы исследования. В основу работы легли собственные сборы и иссле-дования автора, проведенные в 1985-2014 гг. на различных водных объектах бас-сейна Оби (рр. Томь, Чулым, Берешское водохранилище), бассейна р. Енисея (си-стемы рек П. Тунгуска, Большой Пит, Большая Хета, Малая Хета, Агул, Кан, Кимбирка, Курейка (с оз. Мундуйским), Мана, Сисим, Сым и др.). Полевые сборы и камеральная обработка собранных гидробиологических проб и ихтиологических проводился по общепринятым методам (Методики изучения биогеоценозов, 1975; Унифицированные методы…, 1977; Правдин, 1966; Типовые методики исследо-ваний…, 1978, 1985; Руководство по методам…, 1983 и др.).
В связи с температурной неоднородностью Берешского водохранилища гидробиологические и ихтиологические пробы отбирались в условно выделенных 4 зонах. Зона 1 - зона мелководья, включающая районы влияния рек Базыр, Береш и Кадат, с температурой воды летом < 20 °С. Зона 2 - центральная зона, темпера-тура воды в летний период достигает 23 0С. Зона 3 - приплотинная зона с измене-ниями температуры воды с июня по сентябрь в пределах 17-24 0С. Зона 4 - зона влияния сбросных теплых вод ГРЭС, температура воды превышает температуру в остальной части водоема (вода подогревается от 13 до 27 °С).
В водотоках пробы фитопланктона отбирали в поверхностном слое воды; пробы микрофитоперифитона – с естественных грунтов по правому и левому берегам реки с глубины 0,2-0,6 м.
Концентрирование проб для анализа видового и количественного состава фитопланктона проводили фильтрационным методом на мембранных фильтрах Владипор № 9 (диаметр пор 0,90 мкм), подсчет численности водорослей – в каме-ре Нажотта объемом 36,5 мм3. Биомассу рассчитывали по среднему объему, при-равнивая форму клеток к близкому геометрическому телу. Анализ общности фи-топланктона различных участков проводился с использованием коэффициента общности видового состава Серенсена по формуле:
К=2с/(а+в),
где а - число видов на участке А, в - число видов на участке В, с - число об-
щих видов.
Разнообразие водорослей планктонного ценоза оценивали по индексу, осно-
ванному на теории информации Клода Шеннона:
Hb=-S*pi*log*2*pi,
где Hb - разнообразие в битах, pi - удельное обилие вида i, находится как
частное от деления биомассы вида i на общую биомассу фитопланктона (Методи-
ки изучения…, 1975; Гольд, Морозова, 2004).
При вычислении индекса оперировали биомассой, так как она полнее отра-
жает разнообразие функциональных связей сообщества фитопланктона. Принад-
лежность водорослей к различным условиям существования (местообитание, рас-
пространение, галобность, отношение к pH, сапробность) определяли по (Барино-
ва, Медведева, 1996; Корнева, Генкал, 2000; Михеева, 1999). Значение отдельных
видов в формировании фитопланктонного сообщества рассчитывали по индексу
доминирования (процент проб, в которых вид преобладает по биомассе) (Кожова,
1973).
Оценка эколого-санитарного состояния качества воды и категории
трофности проводилась на основании изучения качественного, количественного и
физиологического состояния фитопланктона, индекса сапробности. Индекс
сапробности (S) рассчитывали методом Пантле и Букка в модификации Сладечека
и с использованием уточненного списка видов-индикаторов:
где Si –индикаторная значимость вида i; Ni – его численность; n – число видов-
индикаторов (Водоросли, 1989; Гольд, 1980; Жукинский и др., 1981; Критерии
оценки …, 1992; Оксиюк и др., 1993).
Зоопланктонные пробы отбирались в соответствии со стандартными реко-
мендациями (Методики изучения…, 1975). Отбор проб производился сетью Дже-
ди (газ № 78) с диаметром водного отверстия 0,25 м.
28
Дальнейшая обработка производилась в камере Богорова под бинокуляром МБС-9. Массу отдельных организмов находили по линейным размерам с помо-щью уравнений связи длины и массы гидробионтов (Балушкина, Винберг, 1979). Для оценки трофического статуса водоема по биомассе зоопланктона использова-лась «шкала трофности», предложенная С.П. Китаевым (Китаев, 1984).
Сбор, фиксация донных беспозвоночных и обработка проб зообентоса про-исходили по общепринятым методикам (Методики изучения…, 1975). При выбо-ре разрезов и станций руководствовались, прежде всего, морфометрическими особенностями водоемов, наличием разнотипных грунтов, а также глубинами и скоростью течения.
Выделение доминирующих комплексов зообентоса проводили с учетом биомассы и численности видов, обилие которых составляло более 50 % суммар-ного. Видовое разнообразие оценивали с помощью индекса Шеннона (по числен-ности) (Финогенова, Алимов, 1976).
Для оценки качества воды по организмам зообентоса использовали индекс сапробности и олигохетный индекс Гуднайта – Уитлея (Финогенова, Алимов, 1976). Сапробиологический анализ проводили с использованием индекса Пантле – Букка в модификации Сладечека (Абакумов, Свирская, 1981), индексы индиви-дуальной сапробности организмов взяты из литературных источников (Унифици-рованные методы…, 1977; Тодераш, 1984; Sladečec, 1973; Wegl, 1983). Классы и категории качества воды определяли в соответствии с нормативами (Гост 17.1.3.07-82). Трофический статус водоема по биомассе зообентоса оценивался по «шкале трофности» С.П. Китаева (Китаев, 1984).
При изучении рыбы были использованы главным образом стандартные, широко применяемые и апробированные многолетней практикой методы полево-го и камерального ихтиологических анализов:
- метод биологического анализа, включающий оценку параметров длины и массы тела, определение пола рыбы, ее физиологического состояния, степени го-товности к нересту, определению стадии зрелости половых продуктов по шкалам зрелости (Правдин, 1966);
29
- метод биометрического анализа, включающий детальное описание про-
порций тела рыбы и оценку счетных признаков и используемый для определения
систематического положения, таксономического статуса рыб и дифференциации
разных форм и локальных группировок (Правдин, 1966);
- методы определения возраста рыб по регистрирующим структурам
(Правдин, 1966);
- методы качественной и количественной оценки питания рыб. Желудочно-
кишечные тракты рыбы обработаны количественно-весовым методом (Методиче-
ское пособие…, 1974);
- математические методы обработки данных - методы биологической
статистики, многомерные методы анализа. Статистическая обработка результатов
проведена по методике Н.А. Плохинского (Плохинский, 1978). При выявлении
степени различия пластических, меристических, ростовых, весовых и пищевых
характеристик рыбы достоверность результатов оценивалась по критерию
Стьюдента:
где x1 и x2 - средние значения признаков, m1 и m2 – ошибки
репрезентативности.
Вариационно-статистическая обработка материалов проведена на ПЭВМ –
«Pentium» с использованием программ Microsoft Excel и Statistica 6.
- оценку состояния рыб проводили визуально по внешним признакам, сви-
детельствующим о функциональных нарушениях в организме рыб, которые про-
являются в изменении формы, цвета и структуры внешних и внутренних органов
рыб.
Отлов рыбы производился стандартным набором ставных сетей с ячеёй 22-
130 мм (площадь каждой сети – 50 м2). Лов осетровых рыб осуществлялся
плавными сетями с ячеёй 60-130 мм. Отлов нельмы – плавными сетями 70-110
мм, закидным неводом с ячеёй в матне 40 мм. Отлов молоди и тугуна
осуществлялся мальковым неводом с ячеей 3,6 мм в матне.
Для исследования питания белого толстолобика применен флуоресцентный метод. Флуоресцентный метод отличается от большинства стандартных гидро-биологических методов исследования более высокой точностью и меньшей тру-доемкостью, что позволяет уменьшить время обработки пробы. Это предоставля-ет возможность проводить экспресс-анализ состояния водных экосистем, опреде-лять концентрацию хлорофилла фитопланктона, измерять его фотосинтетическую активность, получая большие массивы данных.
В работе использованы материалы опытных работ в области рыбоводства с енисейскими осетровыми на научно-производственном комплексе ФГБНУ «НИИЭРВ» (рыбоводный цех при Красноярской ТЭЦ-2) (1997-2007) (Детлаф и др., 1981; Мильштейн, 1980). В исследованиях на бассейновых хозяйствах использовались рекомендации по выращиванию молоди и формированию маточных стад осетровых рыб И.А. Бурцева и др. (1984), И.И. Смольянова (1987), Т.Г. Петровой (1977), С.Б. Подушки (1996, 1999б) и других.
Для гормональной стимуляции применялся ацетонированный гипофиз осетровых рыб и его синтетический аналог – сурфагон (Гончаров, 1984; 1990)
Обесклеивание икры производилось суспензией речного ила вручную; отмывка икры – в специальном сачке, позволяющем за короткое время (15-20 с) удалить частицы ила без потерь. Стадии развития икры и молоди указаны по Т.А. Детлаф и др. (1981).
Рационы молоди рассчитывались по методике Г.Л. Мельничука (1978).
При оценке доли пищи, усваиваемой в процессе пищеварения, принимали величину равную 80% (Винберг, 1956). Для количественной оценки эффективности влияния используемой пищи на рост молоди использовали коэффициент К1 (Винберг, 1956; Мельничук, 1978):
К1 = Р/С,
где Р – весовой прирост рыбы, С – величина потреблённой пищи.
Для определения потенциального роста осетра использовалось уравнение роста:
W = (N (1-a/b) (t1-t0) + W01-a/b)b(b-a),
где N – константа; a/b – показатель степени при массе в уравнении зависимости потребления кислорода от массы рыбы; t-t0 – промежуток времени; W0 – начальная масса (Гершанович и др., 1987).
Статистическая обработка всех полученных данных проведена с помощью компьютерных программ Exell, Statistica.
При подращивании молоди использовались следующие корма: декапсулированные яйца, науплии и рачки артемии салины, комбикорм производства Дании Aller Krystal.
При разведении нельмы использованы результаты рыбоводных работ в 1992-1996, 1999, 2001-2007 гг. Применялись методы работ, обычные для индустриального осетроводства и сиговодства (Буланов, 1974, 1976, 1977; Заделенов, Куклин, 1996; Летичевский, 1983; Методические указания по заводскому…., 1979).
При получении и подращивании молоди ленка, тайменя и хариуса во временных рыбоводных комплексах модульной комплектации в Северо-Енисейском (2001, 2003), Сухобузимском (2010 г.), Ирбейском (2010-2013 гг.) и Манском (2011-2013 гг.) районах Красноярского края применялись стандартные методы работ при разведении лососевых рыб, кроме того использовались собственные наработки (Заделенов, 1998а; К воспроизводству..., 2010). При подращивании молодь указанных видов кормили декапсулированными яйцами, рачками (замороженными) и науплиями артемии, комбикормами «Aller Aqua».
Для исследования динамики популяции стерляди и сибирского осетра р. Енисея использована математическая модель, представляющая дискретный вариант модифицированного уравнения Ферстнера – Мак – Кендрика:
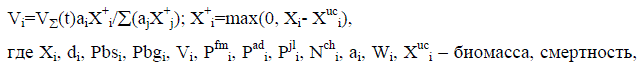
Фактор корма - f(K, X) определяется в следующем виде:
fs(K,X,Pbsi)=Min(1,K/(XCb)); (2)
где К и Cb– доступное количество корма и удельный рацион.
Смертность di восстанавливается на основе условия равновесия биомассы популяции
где NN – реальное число нерестов на самку в течение жизни.
В качестве базисной функции для восстановления вида возрастного распре-деления смертности используется выражение:
где ТL – предельный возраст, Тm – возраст минимальной смертности dm, de –максимальное значение смертности (обычно при ТL).
Для оценки воздействия на ихтиофауну при производстве горных работ, а также работ по обустройству Ванкорского, Тахомо-Юрубченского нефтегазовых месторождений, влияния угледобывающей промышленности, строительства Нижне-Курейской ГЭС проведены комплексные исследования рек бассейнов
33
Большой Хеты (2005 г.), Курейки (2008 г.), Томи (1991), Большого Пита (1988, 2001 г.), Подкаменной Тунгуски (2000-2004 гг.), Сыма (2001 г.), Чулыма (2004-2005 гг.), Агула (2003 г.), Барги (2007, 2013 гг.).
Применяемые приборы и оборудование. Пробы зообентоса отбирали дно-черпателем Петерсена (площадь захвата 1/40 м2) и круговым скребком Дулькейта (площадь захвата 1/9 м2).
Флуориметр для измерения флуоресценции хлорофилла фитопланктона. Принцип работы прибора основан на регистрации флуоресценции хлорофилла при непрерывном освещении испытуемого образца светом заданной интенсивно-сти и спектрального состава. Функционально оптическая часть прибора делится на систему возбуждения флуоресценции, кюветное отделение, блок фотоприем-ника. В систему возбуждения входят: галогенная лампа КГМН-12-20 с непрерыв-ным широкополосным спектром излучения, параболический отражатель и систе-ма светофильтров, позволяющая варьировать спектральный состав и интенсив-ность возбуждающего света. Максимальная облученность пробы может достигать 180 Вт/м2 ФАР.
Комплект светофильтров обеспечивает выделение четырех спектральных участков возбуждающего света. Это достигается с помощью цветного стекла СЗС–22 и трех интерференционных светофильтров 440±10, 510±7 и 540±7 нм. Стекло СЗС-22 толщиной 3 мм позволяет выделять свет на уровне пропускания 0,1 в диапазоне длин волн 380-600 нм. Ввод светового пучка в кюветное отделе-ние регламентируется подвижной шторкой.
Кюветное отделение включает: рабочую кювету объемом 15 мл, магнитную мешалку, обеспечивающую активное перемешивание пробы, кюветодержатель, защитную шторку, прерывающую световой поток перед блоком фотоприемника. Блок фотоприемника, расположенный под углом 90о по отношению к возбужда-ющему лучу, состоит из светофильтров ПС-8 и КС-19 в извлекаемой оправе, мо-дулятора фотоэлектронного умножителя ФЭУ-100 со спектральной чувствитель-ностью катода до 830 нм. Чувствительность прибора по хлорофиллу составляет 0,1 мкг/л. Масса флуориметра - 12 кг, а габаритные размеры - 330х360х160 мм.
34
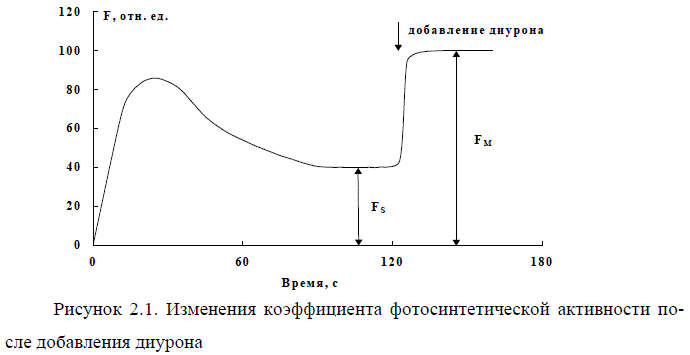
При воздействии различных экологических факторов и антропогенных за-грязнителей изменяется фотосинтетическая активность фитопланктона. Актив-ность фотосинтетического аппарата водорослей определяют по параметрам переменной флуоресценции (Заворуев и др., 2001). Для этого пробу природной воды помещают в кюветное отделение флуориметра и регистрируют медленную индукцию флуоресценции (рис. 2.1). После достижения стационарного уровня (Fs), в пробу добавляют ингибитор транспорта электронов - диурон в концентра-ции 10-5 М. Интенсивность флуоресценции резко возрастает и достигает макси-мального значения (Fm).
Коэффициент фотосинтетической активности (КФА) фитопланктона рас-считывают по формуле:
КФА = Fv / Fm = (Fm - Fs) / Fm.
При неблагоприятных экологических условиях параметр Fv/Fm близок или равен нулю, а в водах, не подверженных антропогенному загрязнению и чистых лабораторных культурах, он достигает значения 0,8 (Левенко и др., 1990). В ми-ровой и отечественной практике этот метод широко используется для исследова-ния физиологического состояния фитопланктона и концентрации хлорофилла в различных биологических пробах (Маторин, 2000; Schreiber et al., 1988; Ostrowska et al., 2000).
Определение концентрации хлорофилла (125 операций) проводилось по ка-либровочной кривой, построенной для каждого водоема и сезона года. Для по-строения графика используется 20-30 измерений флуоресцентного сигнала, полу-ченного после добавления диурона, и соответственно столько же измерений кон-центрации пигмента, определенного стандартным методом (SCOR – UNESCO, 1966). Проведено за период работ 622 измерения флуоресценции.
Рисунок 2.1. Изменения коэффициента фотосинтетической активности по-
сле добавления диурона
Концентрацию хлорофилла вычисляли согласно формуле, представленной в
работе (Wintermans, De Mots Spectrophotometric …, 1969):
где 649 E и 665 E - поглощение экстракта на 649 и 665 нм; E V - объем 96% этано-
ла в мл, взятого для экстракции хлорофилла; F V - объем профильтрованной воды в
литрах; l – толщина кюветы в см.
Качественную реакцию на присутствие сероводорода в пробах воды прово-
дили с помощью азотнокислого свинца. При наличии сульфида образовывался
темно-коричневый (почти черный) осадок PbS:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Биолюминесцентный анализ основан на способности светящейся бактерии
излучать свет в видимой области спектра, а также на высокой чувствительности
их люминесцентной системы к действию различных веществ (анестетиков,
нефтепродуктов, промышленных ядов, инсектицидов и других ингибиторов био-
логической активности). Эффект действия токсических веществ на биолюминес-
центную систему бактерий выражается в уменьшении или, иногда, в увеличении
интенсивности свечения. Кинетика изменения свечения зависит от концентрации и природы исследуемого соединения (Заворуев, Кузнецов, 2000).
Для оценки действия на люминесценцию бактерий проб воды из рек, озер и других водоемов используется бактериальный индекс (БИ), который определяется по формуле:
БИ = IО / IК ,
где IО - интенсивность свечения после добавления анализируемого образца, IК - интенсивность люминесценции в контроле.
Токсичность рассчитывается по формуле:
где X i, o и X i, k - величины интенсивности биолюминесценции в опыте и контроле соответственно; n - количество измерений.
О токсичности анализируемой воды судили по величине Р. Вода считалась токсичной, если величина Р была больше или меньше контроля на 15% (Kuznetsov et al, 1999).
В исследованиях по определению токсичности воды использовались лиофилизованные светящиеся бактерии вида Photobacterium phosphoreum. Кроме того, применялся микробиосенсор B17 677F и экотест, созданный на основе генетически модифицированного штамма Escherichia coli Z905, в который с помощью плазмиды PHL1 был встроен lux ген из Photobacterium leiognathi (Kuznetsov et al, 1999).
Методика биотестирования. Лиофилизованные бактерии реанимировались в течение 30 минут при комнатной температуре. В это время к исследуемым об-разцам воды добавляли NaCl до конечной концентрации 3% в том случае, когда использовался препарат, изготовленный на основе Ph. phosphoreum, и 0.9% для препаратов на основе E. coli. Контролем служила дистиллированная вода с соот-ветствующим содержанием хлористого натрия. Исследуемые растворы разливали по 1 мл в кюветы и туда же добавляли 20 мкл лиофилизованных бактерий. Каж-дую пробу анализировали в 3-5 - кратной повторности.
Для инкубации икры осетровых рыб применялись: инкубатор «Осётр» (Белоярский рыбоводный завод); инкубационное устройство собственной конструкции с применением ультрафиолетового облучения для подавления сапролегнии (рыбоводное хозяйство ПО КХК «Енисей»); инкубационное устройство собственной конструкции для инкубации икры осетровых и других рыб (Заделенов, Ягин, 2000). Икру нельмы инкубировали в аппаратах Вейса, рыбу подращивали в бассейнах ИЦА-2 площадью 4 м2, емкостях силосного типа объемом 7 и 17 м3.
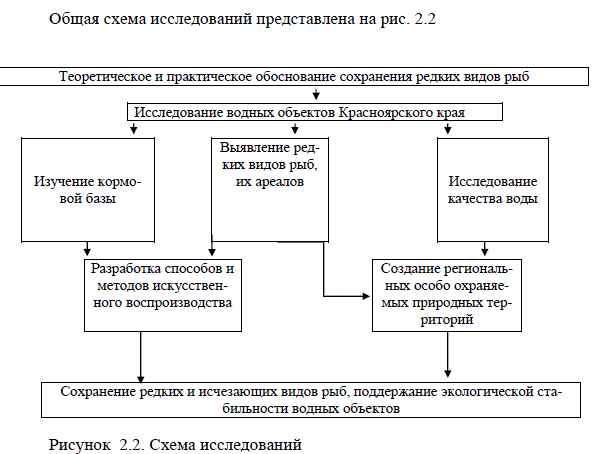
Общая схема исследований представлена на рис. 2.2
Рисунок 2.2. Схема исследований
Температура воды и концентрация растворенного кислорода измерялись термооксиметрами Хориба У-7 (1986-1996 гг.) КИТ-1 (1997-2007 гг., 2010-2014 гг.). Массу молоди в процессе роста определяли по результатам отбора материала из опытных бассейнов и взвешиванию каждого экземпляра на торсионных весах ВТВ-400 и ВЛКТ-500 один раз в 5 суток. Измерения длины рыб проводили
штангенциркулем с точностью до 0,1 мм, массу рыбы определяли при помощи медицинских весов (погрешность – ±2 г), настольных электронных весов «Штрих АС» (погрешность - ±2 г), аптечных весов (погрешность - ±0,01 г)
Определение возраста рыбы проводилось по чешуе, шлифованным спилам маргинальных лучей, отолитам с помощью бинокулярного микроскопа МБС-1, МБС-10.
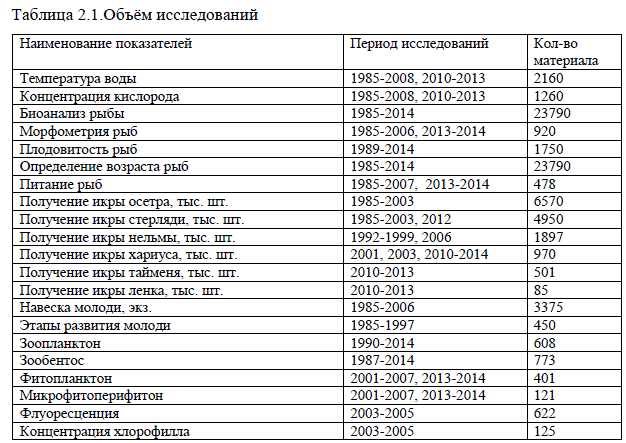
Материалы исследований. За время работ собраны и обработаны материалы, вид и количество которых представлено в табл. 2.1.
Таблица 2.1.Объём исследований
На рыбоводном хозяйстве НПК ФГБНУ «НИИЭРВ» разработана биотехнология формирования ремонтно-маточного стада енисейских осетровых в условиях индустриального выращивания и сформировано опытное ремонтно-маточное стадо енисейских осетровых. Продукционное стадо сибирского осетра
39
на 27.11.2014 г. состоит из 210 экз. массой 3760 кг; стерляди – 671 экз. массой 2518 кг.
Разработана биотехнология формирования ремонтно-маточного стада нельмы в условиях индустриального выращивания. К началу 2008 г. опытное ре-монтное стадо нельмы состоит из 250 особей 2002 г. рождения общей массой око-ло 1000 кг.