1. Разработка метода массового получения гиногенетических.
Для получения гиногенетического потомства у видов, размножающихся обычным половым путем, необходимо решить две основные задачи: 1) разработать технически простой и эффективный способ генетической инактивации спермиев и 2) выбрать наиболее адекватный для данного вида способ диплоидизации женского хромосомного набора.
Известно, что генетическая инактивация мужского набора хромосом сравнительно просто достигается путем обработки спермы высокими (инактивирующми) дозами радиации (ионизирующей или ультрафиолетом), которые вызывают разрушение хромосом, но не нарушают способности спермиев проникать в клетку и стимулировать ее развитие (РомаШов, Беляева, 1965а; Черфас, 1975; Черфас, Цой, 1984).
Определение инактивирующих доз УФ-облучения. При работе с пелядью из известных способов инактивации спермиев было выбрано ультрафиолетовое облучение как наиболее технически доступное и апробированное (Мантельман и др., 1980). Определение дозы инактивирующего действия, необходимой для генетической инактивации спермы пеляди, проводилось с использованием цитологического метода, который позволил установить плоидность 3-4-дневных эмбрионов, полученных в результате осеменения яйцеклеток спермой, облученной разными дозами ультрафиолета. Плоидность определяли путем прямого подсчета хромосом в метафазных пластинках на давленых препаратах.
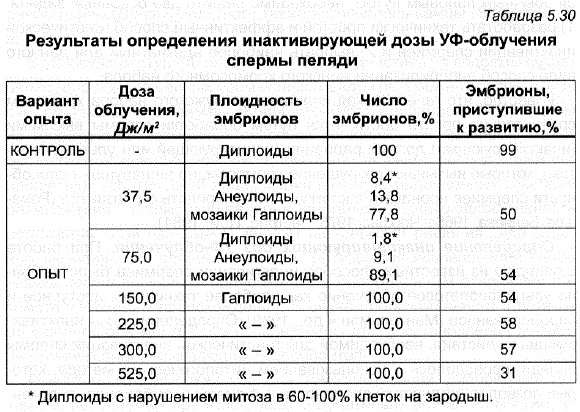
- Известно, что при инактивации генетического аппарата спермиев угиногенетических ЭмбриоНОВ наблюдается большая неоднородность в составе хромоСОМНЫХ КОМПлексов. Часто встречаются гаплоиды, диплоиды – редки, преобладают эмбрионы мозайки с непостоянным числом хромосом от гаплоидного до тетраплоидного набора (Ромашов и др., 1960; Ромашов, Беляева, 1965; Цой, 1969; Черфас, 1975). Аналогичные результаты были получены и при работе с пелядью (табл. 5.30) Роге компровео у нэг онов, ВНЕСЕНТАЕВА НАНОВА сУже при дозах УФ-облучения 37,5 и 75 Дж/м? подавляющее число развивающихся эмбрионов было гаплоидным. По-видимому, эти дозы оказались сублетальны, поскольку в этих потомствах встречались немногочисленные диплоидные эмбрионы, имевшие большой процент клеток с нарушенным митозом.
При дозе УФ-облучения 150 Дж/м? (экспозиция 10 мин, общая доза – 3 тыс, эрг/мм?) все исследованные эмбрионы оказались гаплоидными, т.е. была достигнута полная генетическая инактивация спермы.
Таблица 5.30 Результаты определения инактивирующей дозы УФ-облучения
* Диплоиды с нарушением митоза в 60-100% клеток на зародыш.
Дальнейшее повышение доз УФ-облучения приводило к снижению оплодотворяющей способности спермы (Полякова, 1985а). При оценке этих данных следует иметь в виду, что истинное оплодотворение происходит ТОЛЬКО В вариантах Диплоидного контроля; во всех остальных вариантах спермий лишь стимулирует развитие яйцеклетки, но оплодотворения не происходит, поэтому в этих случаях термин «процент оплодотворения» означает КОличество приступивших к развитию ГИНОГенетических диплоидов и гаплоидов (Мантельман, 1980). Ако нас Врата
на маса Частота появления гиногенетических диплоидов в результате естественных (не индуцированных) нарушений процесса редукции женских хромосом в мейозе очень низка и колеблется у разных видов рыб от о до 0,3% (Черфас, Цой, 1984). Поэтому для использования гиногенеза в практике селекционных работ необходимо решить еще одну очень важную и особенно сложную проблему – разработать метод повышения частоты диплоидизации женского набора хромосом для получения жизнеспособного гиногенетического потомства в достаточном для дальнейшей работы количестве.
Применение температурных шоков. Известно, что при индуцированном гиногенезе у рыб к повышению количества диплоИДНЫХ ГИногенетиче СКИХ ПОТОМКОВ приводит применение температурных ШОКОВ (Головинская и др., 1963; Ромашов, Беляева, 1965а, б; Черфас, 1975; Сѕаnуi, Horvath, 1976; ПоляКова, 1982). Однако процент ВЫХода ДИПЛОИДНЫХ ГИНОГенетических личинок в значительной степени зависит от стадии развития, на которой находится ядро Яйцеклетки В момент начала температурного воздействия.
Поскольку хронология процесса завершающих фаз второго деления мейоза в ядре яйцеклетки пеляди была неизвестна, на первых этапах работы по применению температурных шоков была изучена скорость протекания этого процесса в оплодотворенной яйцеклетке (Полякова, 1980). Было установлено, что через 40 мин после осеменения ядро яйцеклетки находилось на стадии анафазы II, через 80 мин — на стадии телофазы, а через 100 мин уже происходило выделение второго полярного тельца (табл. 5.31). Таким образом, стадия анафазы ІІ оказалась более продолжительной, чем у других изученных видов рыб; она наступает вскоре после осеменения, которое активирует остановившийся на стадии метафазы ІІ процесс мейоза, и заканчивается через 80 мин, когда ядро переходит к стадии ранней телофазы II. Выделение второго направленного тельца происходит через 100 мин После осеменения. Это означало, что поиск наиболее благоприятного момента начала температурного воздействия на яйцеклетки пеляди ограничивался первыми 60 мин после осеменения, когда ядро яйцеклетки проходило стадию анафазы ІІ.
Таблица 5.31 Хронология второго мейотического деления и оплодотворения в осемененной яйцеклетке пеляди при температуре 2-6° C
Средняя анафаза второго деления мейоза Поздняя анафаза второго деления мейоза Ранняя телофаза второго деления мейоза. Появление сияния вокруг мужского пронуклеуса и центросомы Выделение второго полярного тельца, формирование женского пронуклеуса Погружение и сближение женского имужского пронуклеусов
Контакт женского и мужского пронуклеусов в 50% клеток Растворение оболочек пронуклеусов в месте контакта, в единичных клетках Слияние пронуклеусов — образование зиготы — истинное оплодотворение, в 50% клеток на Погружение и набухание ядра зиготы, в 50% клеток В остальных клетках наблюдается контакт или начало слияния пронуклеусов
Для повышения частоты диплоидизации женского набора хромосом у рыб чаще всего используют температурные воздействия – резкое охлаждение или нагрев икры, при этом механизм действия таких шоков различен. Так, охлаждение икры на длительный период приводит к задержке отделения второго полярного тельца, которое после снятия шока уже не может выделиться (Ромашов, Беляева, 1965б). В результате кратковременного нагревания икры до сублетальных температур происходит разрушение веретена деления, что и в этом случае препятствует выделению второго полярного тельца (Насонов, Александров, 1940; Андронников, 1964; Астауров, 1973). Условия температурного шока – температура и длительность воздействия – строго индивидуальны для каждого вида рыб, при этом для многих видов наиболее результативными оказались температурные шоки, начатые на стадии ранней или средней анафазы второго деления мейоза (Ромашов, Беляева, 1965).
В ходе многолетних экспериментальных исследований по определению наиболее эффективных для пеляди параметров температурных шоков было проведено 150 скрещиваний при использовании в каждом разного количества икры (Полякова, 1987) — по 3-5 тыс. икринок от отдельных самок (индивидуальные потомства) и по 100-300 тыс. от смеси большого количества самок (массовые скрещивания). В итоге во время разработки метода было проинкубировано более 1,5 млн икринок. В процессе инкубации определяли процент оплодотворения (количество дробящихся эмбрионов) и процент развития (выживаемость на разных этапах эмбриогенеза). Об эффективности температурных воздействий судили по трем критериям: частоте диплоидизации, количеству диплоидов на 95-100-е сутки эмбрионального развития и количеству вылупившихся диплоидных личинок. В процессе этой работы с помощью цитокариологического анализа была определена плоидность более 7000 эмбрионов.
Для установления оптимальных параметров температурных шоков в этих опытах варьировали время начала воздействий (от 0 до 55 мин. после осеменения), их длительность (15—40 мин) и температуру прогрева (16-259) или охлаждения икры (0,7-2,09). В качестве контроля использовали 2 варианта: потомства с использованием инактивированной спермы, но без температурных воздействий (Kn) и потомства от тех же самок, но без облучения и применения шоков — K (2n), что позволяло контролировать качество икры, использованной в опытах.
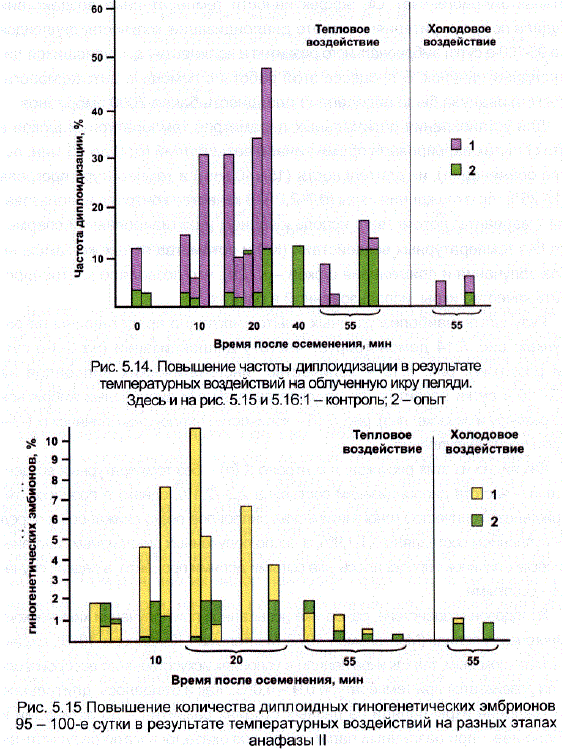
Результаты наиболее удачных опытов наглядно представлены на рисунках: рис. 5.14 демонстрирует частоту диплоидизации (на 3-4-е сутки развития), рис. 5.15 – количество гиногенетических диплоидов на 95-100-е сутки развития (по результатам разборки ДИПЛОИДНЫХ эмбрионов по размеру и окраске глаз), рис. 5.16 — КОЛИчество ДИПЛОИДНЫХ ЛИчинок в 1-2-е сутки После вылупления.
Как видно из этих рисунков, в контроле к (п) — без температурных воздейСТВий — частота диплоидизации составила 2,2-12,1%, однако в процессе эмбриогенеза количество ГИНОГенетических диплоидов резко СНИжалось и перед Вылуплением составляло 0,1-1,9%, а число ПолученНЫХ ДИПЛОИДНЫХ ГИногенетических личинок определялось уже сотыми долями процента, в редких случаях – десятыми.
Холодовое воздействие, ранее уже испытанное при получении химического Гиногенеза у пеляди (Мантельман, 1978; Мантельман, Кайданова, 1978), трудно назвать ШОКОВЫМ, так как икра пеляди в усЛОВИЯХ ИСкусственного воспроизводСтва развивается при температуре 0,9 – 4,0°С.. Как и ожидалось, длительное охлаждение икры пеляди на разных стадиях развития – до активации и после нее – при различных параметрах доз оказалось мало результативным для этого вида рыб (см. рис. 5.14-5.16). Холодовые воздействия (0°, 240 мин. и 0°, 270 мин.) через 55 мин. После осеменения приводили к 2-кратному ПОВышению частоты ДИПЛОИДизации по сравнению с контролем, но на последующих стадиях эмбрионального развития результаты в опыте и контроле ПОЧти не различались (Полякова, 1982).
Рис. 5.14. Повышение частоты ДИПЛОидизации в результате температурных воздействий на облученную икру пеляди.
Рис. 5.15 Повышение количества диплоидных гиногенетических эмбрионов 95 – 100-е сутки в результате температурных воздействий на разных этапах анафазы ІІ
Время после осеменения, мин Рис. 5.16. Повышение количества диплоидных Гиногенетических лиЧИНОК В результате температурных воздействий на разных этапах анафазы ІІ
Впервые примененное на икре пеляди тепловое воздействие действительно оказалось шоковым, поскольку перепад температур от оптимальных до экспериментальных значений составлял от 15 до 23° (Полякова, 1985б).
Термообработка яйцеклеток (16°, 40 мин), начатая сразу после осеменения, не привела к значительному повышению частоты диплоидизации (2,5-12,3%), и численность гиногенетических диплоидов перед вылуплением также незначительно отличалась от контроля (0,8-1,9%), но число гиногенетических личинок было уже на порядок выше.
Спустя 10 мин после осеменения та же доза тепла (16°, 40 мин.) повышала частоту диплоидизации до 6,1-31,1% и приводила к увеличению количества гиногенетических диплоидов перед вылуплением до 4,7-7,7%, а также значительно – на 2 порядка — по сравнению с контролем увеличивала число гиногенетических диплоидных личинок (см. рис. 5.15,5.16). Прогрев икры, начатый через 20 мин после осеменения (16°, 30 мин.), увеличивал частоту диплоидизации до 35,0%, количество гиногенетических диплоидов перед вылуплением — до 6,7% и число гиногенетических личинок – до 3,5%, что было на два порядка выше, чем в контроле. Термовоздействие (16°, 40 мин) приводило к увеличению частоты диплоидизации до 11,0-26,0%; количество диплоидов перед вылуплением колебалось в разных опытах от 0,7 до 2,0-10,6%, а число гиногенетических личинок – от 0,3 до 3,4-6,4%. Это также было на 1-2 порядка выше, чем в контроле. Однако та же доза термообработки яйцеклеток (16°, 40 мин.) через 40 мин после осеменения) оказалась уже менее эффективной, чем через 20 мин. Частота диплоидизации при этом снизилась до 12,5%, а Количество диплоидов перед вылуплением — до 1,3%* (здесь и в других опытах результаты, помеченные *, означают, что число гиногенетических личинок в этих вариантах по техническим причинам определить не удалось).
Увеличение экспозиции до 55-95 мин. при температуре 15-18° привело к снижению частоты диплоидизации от 7,7 до 3,3%, а количества гиногенетических диплоидов перед вылуплением – от 1,1 до 0,4%, т. е. почти до уровня контроля. Повышение шоковых температур до 18-17° и экспозиции до 75 и 95 мин. приводило к возрастанию частоты диплоидизации в среднем, но сохранялась та же тенденция, т. е. при одной и той же температуре увеличение экспозиции снижало частоту диплоидизации (от 19,0 до 15,5%). Количество диплоидов перед вылуплением было в этих опытах очень мало — 0,2*, т. е. на уровне контроля.
Более экстремальные воздействия, т. е. повышение температуры или увеличение экспозиции, хотя и приводили к повышению частоты диплоидизации на стадии бластулы, но в результате резкого снижения выживаемости в целом на стадии гаструлы — ранней нейрулы число гиногенетических диплоидов также значительно снижалось. Так, при увеличении температуры воздействия до 25-26° была получена самая высокая частота диплоидизации – 59,2%. Однако численность гиногенетических диплоидов перед вылуплением составляла лишь 3,8%.
Таким образом, при разработке метода индуцированного гиногенеза у сиговых рыб на икре пеляди было впервые исследовано действие теплового шока на разных этапах анафазы ІІ (Полякова, 1982, 1985б). Найболее эффективной оказалась следующая схема: начало шока – через 20 мин после активации яйцеклеток (ранняя анафаза II); температура 16°C; длительность 40 мин (Полякова, 1985б). Этот способ получения диплоидного гиногенеза у пеляди был защищен авторским свидетельством (Полякова и др., 1986). Использование его позволило увеличить количество диплоидных личинок в первом гиногенетическом поколении в 80-300 раз, а во втором — в 400-1000 раз по сравнению с контролем и стабильно получать массовые партии гиногенетических потомств – от одной до нескольких тысяч сеголеток (Полякова, 1987). Это дает возможНОСТЬ ИСПОЛЬЗОвать гиногенез в селекционно-генетической работе с пелядью, которая является ценным объектом аквакультуры.
Доказательства полной генетической инактивации мужских хромосом. Для дальнейшей работы с гиногенетическими потомствами важно установить тип гиногенеза, поскольку от этого зависят генетические особенности получаемых потомств. Описаны два типа гиногенеза (Черфас, 1978) — амейотический, как следствие исключения мейоза и замены его одним или двумя делениями митоза (для случаев естественного гиногенеза), и мейотический, при котором яйцеклетка проходит мейоз (конъюгацию и редукцию хромосом), а восстановление диплоидности происходит в результате возвращения второго направительного тельца. Этот способ восстановления плоидности на разных фазах || деления мейоза нашел широкое применение при индуцированном гиногенезе у рыб, что объясняется доступностью половых продуктов на этой стадии и синхронностью протекания процесса мейоза во всех яйцеклетках.
Генетические последствия мейотического гиногенеза рассматриваются как в оригинальных (Головинская, Ромашов, 1966; Головинская и др., 1969; Черфас, 1977), так и в обзорных работах (Stanley, Sneed, 1974; Головинская и др., 1977; Черфас, 1979; Chourrout, 1982; Purdom, 1983; Черфас, Цой, 1984). Такой механизм диплоидизации приводит к расщеплению в потомствах ик высокому уровню гомозиготизации гиногенетических особей. Ранее это было доказано исследованием расщепления в гиногенетическом потомстве по признакам чешуйного покрова у карпа (Головинская, Ромашов, 1966) и косвенно подтверждено работой венгерСких исследователей (Сѕаnуi, Horvath, 1976). Использование генетичеСких маркеров в дальнейшем позволило уточнить скорость достижения гомозиготности по отдельным генам, которая зависит от частоты кроссинговера по различным генам — 5,4-60,7% (Черфас, 1978; Черфас, Трувеллер, 1978; Nagy, Csanyi, 1982; Thompson, 1983).
Полученное у пеляди увеличение выхода гиногенетических диплоидов при шоковом воздействий на стадию анафазы второго деления мейоза послужило доказательством того, что диплоидность в яйцеклетке пеляди восстанавливается в результате возвращения женских хромосом, в норме отходящих во второе полярное тельце, и объединения их с женским пронуклеусом. Таким образом, можно полагать, что гиногенез у пеляди, как и у карпа, мейотического типа. Косвенное подтверждение мейотического типа гиногенеза у карпа было получено ранее (Сѕаnуi, Horvath, 1976).
При разработке гиногенеза у пеляди, как специального метода селекции при работе с сиговыми рыбами, необходимо иметь доказательства полной генетической инактивации мужских хромосом. При проверке гиногенетического потомства по морфологическим признакам подбирают самцов, гомозиготных по доминантному аллелю гена-маркера, и рецесСивных самок (Ротт, Терская, 1974). К таким генетическим маркерам у рыб относятся гены, определяющие строение чешуйного покрова (Кирпичников, 1937), которые неоднократно применялись для доказательства отсутствия мужской наследственности у карпа (Ромашов и др., 1960; Головинская и др., 1963; Черфас, 1977) и окраски, использованные при получении гомозиготных диплоидных клонов у Brachydаnio rerio (Streisinger et al., 1981). А et al., 1981).
Если у некоторых видов рыб генетические маркеры были не изучены, результативность того или иного воздействия выявлялась при гибридных скрещиваниях. Проявление у потомков только материнских признаков является несомненным доказательством генетической инактивации сперматозоидов. Так, было доказано отсутствие мужской наследственности при анализе морфологических признаков у гиногенетических потомков в радиационном гибридном гиногенезе у осетровых (Ромашов и др., 1963), у карпа (Ромашов и др., 1960; Головинская и др., 1963) иу белого толстолобика (Макеева, Корешков, 1982).
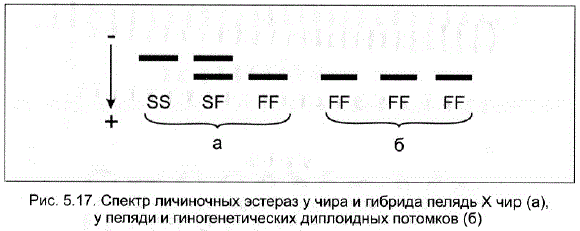
Открытие в 70-х гг. биохимических маркеров позволило использовать методы биохимической генетики для подтверждения гиногенеза у карпа и белого толстолобика (Черфас, Трувеллер, 1978; Макеева, Корешков, 1982 и др.). - Для подтверждения гиногенетического происхождения диплоидных потомков при радиационном гиногенезе у пеляди была использована облученная сперма другого вида, а именно чиpa (Полякова и др., 1983). Применение биохимического контроля в этом случае стало возможным в результате обнаружения различий в спектрах личиночных эстераз у пеляди, чира и гибрида пелчира (Локшина, 1983).
В проведенном исследовании было показано, что пелядь отличается от чира по спектру личиночных эстераз – у пеляди наблюдалась фиксация аллеля Fв то время как чир и гибрид пелядь x чир обнаруживали полиморфизм по локусу Est-1 с наличием всех трех возможных генотипов SS, SE и FE. Гиногенетические диплоиды обладали генотипом FF, характерным для пеляди (рис. 5.17).
Рис. 5.17. Спектр личиночных эстераз у чира и гибрида пелядь X чир (а), у пеляди и гиногенетических диплоидных потомков (6)
Цитологический метод в работах по гиногенезу у рыб применяли лишь для определения плоидности полученных гиногенетических личинок. Анализ гиногенетических 1--2-дневных личинок проводили по числу ядрышек в ядрах эпителиальных клеток плавниковой каймы на вьюне, карпе и стерляди (Ромашов и др., 1960; Головинская и др., 1963; Ромашов и др., 1963; Ромашов, Беляева, 1965; Черфас, 1975). Однако эти методы определения плоидности можно расценивать как ориентировочные. Точная оценка плоидности и принадлежности кариотипа определенному виду возможна лишь путем подсчета числа хромосом в метафазных пластинках.
При использовании цитокариологического метода для оценки кариотипа гиногенетических диплоидов их сравнивали с кариотипами пеляди, чира и их гибрида -пелчира (Кайданова, 1980, 1983). Как известно, кариотип пеляди (см. подробнее гл. 6), характеризуется модальным диплоидным числом хромосом – 2n=74 при NF=94-96, в том числе 20-22 двуплечие хромосомы (рис 5.18). Кариотип чира имеет модальное диплоидное число хромосом – 2n=58 при NF=94--96 и 36--38 двуплечих хромосом (рис. 5.19). Описание гибридного кариотипа пелчира проведено впервые. Модальное диплоидное число хромосом пелчира - 2n=66, из них 22 двуплечие хромосомы, что соответствует NF=94 (рис. 5.20). Кариологический анализ гибрида (пелчира) подтвердил промежуточное состояние его кариотипа по сравнению с кариотипами родительских форм.
Рис. 5.18. Кариотип пеляди (Coregonus peled) – 2 n=74, в том числе 20-22 двуплечие хромосомы
Рис. 5.19. Кариотип чира (Coregonus nasus) – 2 n=58, в том числе 36-38 двуплечих хромосом
По результатам цитокариологического анализа гиногенетические диплоидные эмбрионы, полученные при радиационном гиногенезе, имели кариотип пеляди, т. е. 2 n=72-76, из них 20-24 – двуплечие хромосомы. Встречающиеся в большом количестве гаплоидные гиногенетические эмбрионы имели гаплоидный набор хромосом пеляди — n=37-38, из них 10-12 - двуплечие хромосомы (рис. 5.21).
Рис. 5.20. Кариотип пелчира – 2 n=66, в том числе 22 двуплечие хромосомы
Рис. 5.21. Гаплоидный кариотип пеляди — n=37 – 38, в том числе 10-12 двуплечих хромосом
Таким образом, полученные результаты цитокариологического исследования гиногенетических диплоидных эмбрионов и биохимического анализа личинок свидетельствовали о том, что гиногенетические потомки у пеляди развиваются только за счет материнского ядра, при полном исключении хромосом отцовского вида. Этот факт послужил доказательством их гиногенетического происхождения.
Еще одним подтверждением гиногенетического происхождения диплоидов при индуцированном гиногенезе у пеляди были данные эмбриологических наблюдений за развитием и сроком выклева личинок в контроле и в опыте. Так, было отмечено, что пелчир вылупляется на 2--3 недели раньше пеляди, а гиногенетические диплоиды, в свою очередь, на 1--2 недели позже пеляди. Важно отметить при этом, что засорение экспериментального материала как на стадии бластулы, так и на личиНочной стадии было исключено.
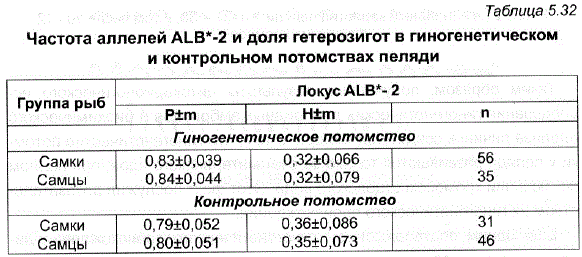
Характерной особенностью первого гиногенетического поколения пеляди являлось наличие в нем самцов, которое нельзя было связать с засорением. В одной генерации было обнаружено 30, а в другой – 25% самцов. Исследования гиногенетических особей методами цитогенетического и биохимического анализов (Полякова и др., 1983) позволили установить причину их появления в потомствах пеляди первого гиногенетического поколения. Выявленная при анализе биохимических маркеров одинаковая частота аллеля локуса альбумина-2 у гиногенетических самок и самцов (табл. 5.32) дает основание предполагать, что наличие самцов в первом гиногенетическом поколении пеляди обусловлено особенностями генетического определения пола у данного вида (Локшина, Полякова, 1985). Вероятно, гетерогаметным полом у пеляди ЯВЛЯЮТСЯ самки. Учитывая, что соотношение полов в гиногенетических потомствах пеляди составляет 1:4 (при нормальном соотношении 1:1), можно предположить, что у пеляди определение пола происходит при участии множественных половых хромосом (99 ZZWW, 33 ZZZZ). Подобный вариант обсуждался в работе В.А. Струнникова (1975), посвященной искусственному мейотическому партеногенезу у тутового шелкопряда.
Таблица 5.32 Частота аллелей ALB*-2 и доля гетерозигот в гиногенетическом и контрольном потомствах пеляди
Получение 2-го гиногенетического поколения. Как известно, получение второго и последующих гиногенетических поколений от первично гиногенетических особей удается во много раз легче, так как в первом поколении происходит отбор генотипов, обладающих высокой способностью к гиногенезу (Астауров, 1973; Черфас, 1975; Черфас, Цой, 1984 и др.). У карпа наблюдалось повышение выхода гиногенетических диплоидов во втором и третьем поколениях индуцированного гиногенеза в сочетании с относительно высокой выживаемостью. Во 2-м поколении Гиногенеза у белого амура аналогичного повышения диплоидизации не наблюдалось.
Повышенная диплоидизация, как характерная особенность при повторном получении гиногенеза, проявилась и у пеляди — при получении 2-го гиногенетического поколения (табл. 5.33).
Таблица 5.33 Сравнительная оценка количества диплоидов в І и ІІ гиногенетических поколениях пеляди
Оказалось, что почти у половины исследованных самок первого гиногенетического поколения обнаружилась высокая способность к диплоидизации в ответ на тепловой шок – 55,5%, в отличие от другой половины, где эта способность составила только 3%. Важно подчеркнуть при этом, что резкое повышение частоты диплоидизации у пеляди, в отличие от карпа, наблюдалось только на фоне теплового шока. Выживаемость эмбрионов второго гиногенетического поколения при этом также повысилась (Полякова, 1987).
Мен ука Благодаря этим фактам впервые в 1985 г. были получены индивидуальные гиногенетические потомства второго поколения пеляди, три из которых удалось вырастить. Гистологический анализ гонад у этих сеголеток показал, что два потомства состоят только из самок, в одном же обнаружен очень незначительный процент самцов (Полякова, Мостовская, 1988а, б; Мостовская, Полякова,. 1988; Богданова, 1991). Таким образом, исходя из данных по половому составу первого и второго гиногенетичеСких поколений можно предположить наличие у пеляди популяционного полиморфизма по генам, определяющим пол (Полякова, 1983; Локшина, Полякова, 1985). Анан к Полякова, 1985).
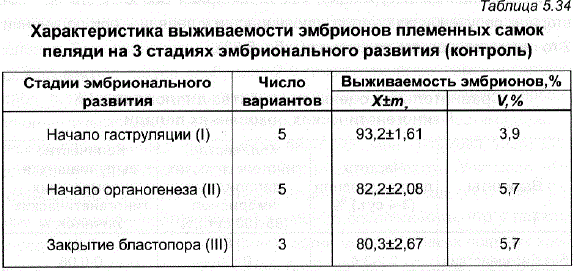
Таблица 5.34 Характеристика выживаемости эмбрионов племенных самок пеляди на 3 стадиях эмбрионального развития (контроль)
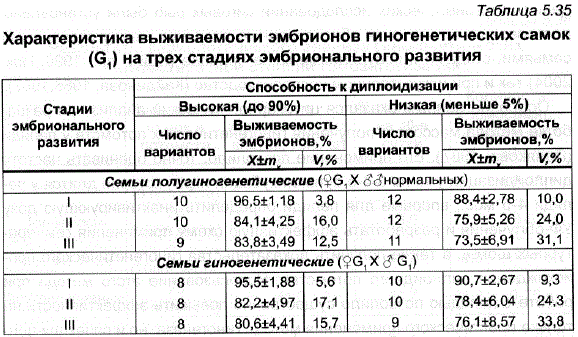
Оценка гиногенетических самок G, по выживаемости их потомства в ранний эмбриональный период показала, что в среднем синогенетические самки давали икру лишь немного более низкого качества, чем контрольные (табл. 5.34,5.35). Важно подчеркнуть, что при этом была выЯвлена повышенная смертность в потомствах некоторых самок, что привело к существенному увеличению изменчивости самок G, по выживаемости их потомства – коэффициенты изменчивости по всем показателям по сравнению с контролем увеличились в 2-6 раз. Вместе с тем группа гиногенетических самок, обладавшая высокой способностью к диплоидизации (до 90%), продуцировала икру с лучшей выживаемостью – на 10-12% выше, чем самки, отличавшиеся низкой способностью к диплоидизации (табл. 5.33), и имела при этом более низкую вариабельность по выживаемости на разных стадиях эмбрионального развития.
Полученные данные позволяют предположить, что при индуцированном гиногенезе у пеляди на фоне теплового шока действительно произошел отбор самок с повышенной способностью к диплоидизации женского хромосомного комплекса. Благодаря этому были получены индивидуальные гиногенетические потомства второго поколения.
Таблица 5.35 Характеристика выживаемости эмбрионов гиногенетических самок (G) на трех стадиях эмбрионального развития