Характеристика хромосомных аберраций в гиногенетических потомствах разной степени гомозиготизации.
Цитокариологический анализ использовали для сравнительной оценки гиногенетических потомств разной степени гомозиготизации: индивидуальные и массовые потомства 1-го поколения гиногенеза (G), потомства от межлинейных скрещиваний гиногенетических линий (л, G, хл, G,), от внутрилинейных скрещиваний (л, G, хл, G), топ-кроссов (лG, хK), а также индивидуальные потомства 2-го поколения гиногенеза (ИП G,), индуцированные отдельно от каждой самки G..
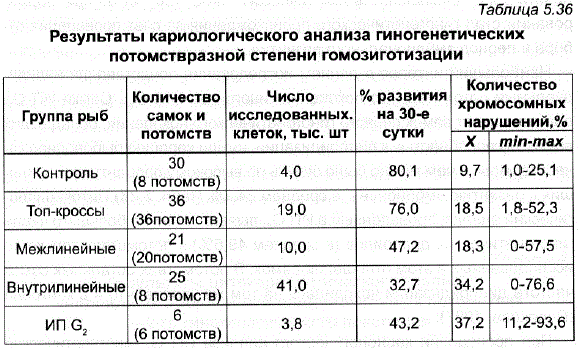
Всего таким способом было исследовано около 5000 эмбрионов (свыше 40 тыс. клеток) из 78 потомств, индивидуальных и массовых, полученных от 118 самок гиногенетического происхождения и племенных, использованных в качестве контроля (табл. 5.36).
Лучшие показатели были получены в контрольной группе рыб. В топкроссах процент хромосомных нарушений оказался в 2 раза выше, чем в контроле, хотя выживаемость сохранялась на довольно высоком уровне. При межлинейных скрещиваниях показатели выживаемости резко снизились, при том, что процент хромосомных нарушений сохранился на том же уровне, что и в топ-кроссах.
Таблица 5.36 Результаты кариологического анализа гиногенетических потомствразной степени гомозиготизации
Наибольшее количество хромосомных аберраций, наряду с низкой выживаемостью, было отмечено в потомствах от внутрилинейных скрещиваний ив семьях, полученных от самок 2-го поколения гиногенеза. Совершенно очевидно, что в гиногенетических линиях G, и тем более во втором поколении гиногенеза проявляется инбредная депрессия, обусловленная повышением степени гомозиготизации по вредным рецесСивным аллелям, что определяет большую смертность эмбрионов уже в раннем эмбриогенезе (см. табл. 5.36). Однако в отличие от племенных стад, в гиногенетических потомствах высокая смертность икры сохранялась в ходе всего эмбриогенеза.
Несмотря на увеличение среднего уровня хромосомных нарушений и Снижение выживаемости в межлинейных и внутрилинейных потомствах, среди межлинейных потомств G, были обнаружены отдельные семьи, имевшие большое число эмбрионов без хромосомных нарушений или с их незначительным количеством (0-6,0%), отличавшиеся высокой выживаемостью — до 80%. - Эти результаты дают основание планировать направленное применение гиногенеза для получения гиногенетических потомств, несущих минимальное количество нарушений ядерного аппарата. Использование данных цитокариологического анализа в этом случае может помочь увеличить долю нормальных в генетическом отношении семей при формировании стад гиногенетического происхождения за счет проведения отбора в период эмбрионального развития.
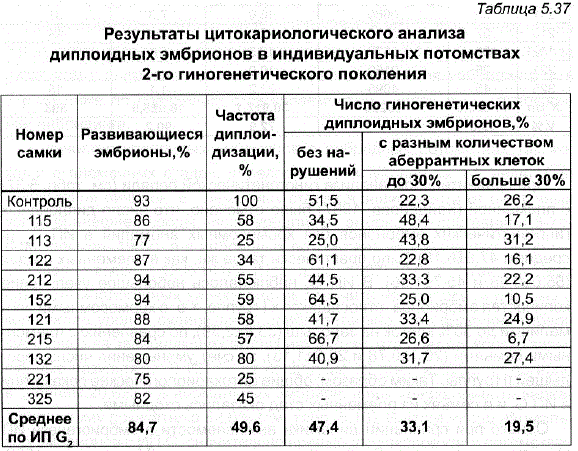
е дна Наибольший интерес в данном исследования представляли индивидуальные потомства 2-го поколения гиногенеза (ИП G,). Самки ИП G., Полученные от самок первого гиногенетического поколения, обладавших высокой способностью к диплоидизации, имели хорошее рыбоводное качество икры, о чем можно было судить по высокому проценту приступивших к развитию эмбрионов – в среднем 84,7% (табл. 5.37) Цитокариологический анализ, проведенный в ИП G,, выявил наличие большого числа гиногенетических диплоидов (в среднем 49,6%) в потомствах только 10 исследованных в этом отношении самок. В потомствах остальных самок частота диплоидизации находилась на том же уровне, что и в контроле (Полякова, 1987). - При проведении кариологического анализа ИП G, гиногенетические эмбрионы были распределены по группам: без нарушений в митозе, с небольшим количеством клеток с хромосомными аберрациями (1 группа – до 30% нарушений на зародыш) и со значительными нарушениями (ІІ группа – более 30% нарушений на зародыш).
Во всех исследованных ИП G, подавляющая часть гиногенетических зародышей (47,4+6,16) так же, как и в контроле (51,5%), не имела хромосомных нарушений (см. табл. 5.37). Количество эмбрионов с хромосомными аномалиями до 10% в ИП G, несколько ниже, чем в контроле.
Во всех ИП G, был проведен анализ динамики выживаемости в эмбриональный период, при этом за 100% принималось число диплоидных гиногенетических эмбрионов, рассчитанное по частоте диплоидизации, которую определяли на 3-4-е сутки эмбрионального развития путем прямого подсчета хромосом в метафазных пластинках на давленых препаратах.
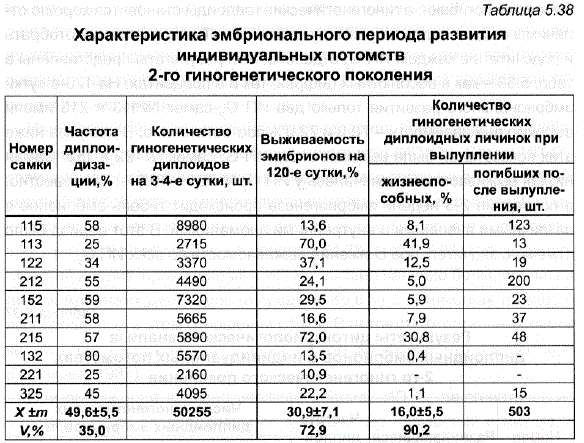
Из-за невозможности визуального отбора гиногенетических диплоидных эмбрионов из массы недpoбящихся, анеуплоидных и гаплоидных зародышей на 20-е сутки эмбрионального развития точные данные по выживаемости ИП G, на указанный период отсутствуют. Только на 120-е сутки эмбрионального развития, когда не- дробящиеся анеуплоидные эмбрионы погибают, а гиногенетические гаплоиды становятся хорошо отличимы от диплоидов по размеру глаз, можно было последних отобрать и подсчитать в каждом ИП G, отдельно. Эти результаты представлены в табл. 5.38 — как в абсолютных цифрах, так и в процентах. На 120-е сутки эмбрионального развития только два ИП G, самок No 113 и 215 имели высокую выживаемость – 70,0 и 72,0% соответственно. В два раза ниже этих показателей была выживаемость , самок No 122 и 152. Самая низкая выживаемость отмечалась у ИП G, No 221 – 10,8%. Как известно, в последние 2-3 недели эмбриогенеза происходит гибель эмбрионов с различными внешними и внутренними аномалиями. В этот период было отмечено значительное снижение выживаемости во всех ИП
Таблица 5.37 Результаты цитокариологического анализа диплоидных эмбрионов в индивидуальных потомствах 2-го гиногенетического поколения
К концу эмбрионального периода наиболее высокая выживаемость и численность жизнеспособных личинок наблюдались в гиногенетических потомствах G, четырех самок No 113,122,152 и 215.
Таблица 5.38 Характеристика эмбрионального периода развития Заказание предприндивидуальных потомств 2-го гиногенетического поколения
При сравнительном анализе гиногенетической пеляди (см. табл. 5.37) с племенной (Кайданова, 1987) было отмечено, что число диплоидных гиногенетических эмбрионов без хромосомных аномалий в ИП G, (в среднем 47,8+6,16) было практически такое же, как в племенных стадах (55,0+0,98 и 45,7+1,36). В ИП G, наблюдалось небольшое увеличение количества эмбрионов, относящихся к I группе, т. е. С хромосомными аномалиями до 30% клеток на зародыш (33,8+2,89), по сравнению с племенными семьями (20,1+0,78 и 22,3+1,13), за счет уменьшения числа зародышей ІІ группы. Таким образом, общие цитокариологические показатели в ИП G, ив семьях из племенных стад оказались сходными.
Однако при сравнении динамики выживаемости в эмбриогенезе ИП G, с племенными и инбредными семьями пеляди (Мантельман, 1982; Черняева, 1987) были отмечены существенные различия. Для племенных стад пеляди известно, что первый пик гибели эмбрионов (25-30%) приходится на 20-е сутки эмбрионального развития и определяется числом эмбрионов с сильными хромосомными нарушениями – больше 30% аберрантных клеток на зародыш (Мантельман, 1982; Кайданова, 1987). Этот факт подтвержден сильной отрицательной корреляцией (-0,61) между уровнем хромосомных аберраций в эмбрионах на стадии бластулы и их выживаемостью (Кайданова, 1987). В дальнейшем гибель развивающихся эмбрионов незначительна и лишь в конце эмбрионального периода, за 2-3 недели до вылупления личинок, наблюдается следующий пик смертности уже почти полностью сформированных эмбрионов.
При оценке этих данных представляло интерес сравнение выживаемости ИП G, с аналогичными показателями, полученными при инбредном разведении пеляди (Черняева, 1986,1987). Оно показало, что выживаемость потомства племенных самок и самок первого поколения инбридинга была одинаковой (соответственно 86,3+2,41 и 86,6t2,61). У самок второго поколения инбридинга выживаемость снизилась по сравнению с племенными (соответственно 60,9 и 80,2%). В ИП G, выживаемость на 120-е сутки развития в среднем составила 30,9+7,14 – была в 3 раза ниже, чем у племенных потомств и первого поколения инбридинга, и в 2 раза ниже по сравнению с выживаемостью пеляди второго поколении инбридинга. От o Количество уродливых эмбрионов в инбредных потомствах так же, как и в племенных стадах, определялось визуально за 1-2 недели до вылупления личинок. В племенных стадах в зависимости от различных условий внешней среды число уродливых эмбрионов составляло 5-7% (Мантельман, 1982), ав инбредных потомствах их количество было существенно выше – 12,8-16,6% (Черняева, 1987). Для гиногенетических потомств аналогичных характеристик получить не удалось, и поэтому о количестве уродов судили лишь приблизительно – по величине гибели эмбрионов на завершающих этапах инкубации, что дает несколько завышенные результаты. ВИП G, за последние 20 дней инкубации погибло в среднем 20,6+3,6% аномальных эмбрионов при коэффициенте вариации по этому показателю 52,6% (см. табл. 5.10). В итоге число аномальных эмбрионов в ИП G, значительно превысило таковое как в потомствах племенных самок, так и во втором поколении инбридинга у пеляди.
Таким образом, несмотря на то, что общая картина кариологического анализа эмбрионов из гиногенетических потомств G, практически не отличалась от аналогичных данных по племенным стадам (Кайданова, 1987), динамика выживаемости в эмбриональный период ИП G, (см. табл. 5.37 и 5.38) резко отличалась от показателей выживаемости как в Племенных стадах, так и в инбредных линиях (Мантельман, 1982; Черняева, 1987).
Средний показатель выхода жизнеспособных личинок в ИП вил лишь 16,0+5,5% при коэффициенте вариации 90,2% (см. табл. 5.38). ВИП G-221 все зародыши погибли в процессе эмбриогенеза, а в двух ИП G, самок No 132 и 325 численность вылупившихся жизнеспособных личинок была очень мала и составила соответственно 22 и 45 шт.
Таким образом, есть все основания полагать, что во втором гиногенетическом поколении пеляди коэффициент инбридинга оказался высоким. Возникшая при этом инбредная депрессия, по всей вероятности, обусловлена повышением степени гомозиготности по вредным рецессивным аллелям. Возможно, выход значительного числа рецессивных летальных аллелей в гомозиготное состояние в большинстве полученных нами ИП G, пеляди привел к потере части потомств уже в эмбриональный период их развития, что, в свою очередь, существенно изменило динамику выЖиваемости ИП G,
Известно, что в первом поколении индуцированного гиногенеза в результате расщепления возникает большое генетическое разнообразие потомков, характеризующихся высокой гомозиготностью (0,6-0,8). Каждая самка первого поколения гиногенеза становится родоначальницей Гиногенетических потомков, отличающихся большим генетическим сходством, и индивидуальные гиногенетические потомства постепенно становятся линиями. В каждом последующем поколении число гетерозиготных локусов уменьшается, коэффициент инбридинга приближается к 1 (Черфас, Цой, 1984).
Уже второе поколение гиногенеза, полученное от одной самки, согласно теоретическим расчетам (Черфас, Цой, 1984), можно считать линией, Коэффициент инбридинга при этом составляет 0,8-0,9, что соответствует 7-8-му поколениям скрещивания сибсов. Генетическая изменчивость в пределах одной линии очень низка. При этом индивидуальные потомства от разных самок первого гиногенетического поколения характеризуются высокой межлинейной изменчивостью. Как было показано выше, аналогичная картина наблюдалась и при исследовании гиногенетических потомств разных поколений и у пеляди (Полякова, 1986,1987).