2. Гетерогенность природных популяций сиговых рыб
Материал и методы
Материалом для исследования природных популяций сиговых рыб послужили выборки из популяций, относящихся к крупным водным бассейнам севера Восточной Европы (реки и озера водосборов Балтийского, Белого и Баренцева морей), Западной Сибири (р. Обь), Восточной Сибири (реки Лена, Колыма), а также оз. Байкал (рис. 6.1).
Образцы тканей белых скелетных мышц и печени брали у свежепойманных рыб непосредственно на местах вылова, замораживали в жидком азоте и переправляли для дальнейшей генетической обработки в лабораторных условиях. Сохраняемые в эппендорфах кусочки мышц и печени заливали равным объемом 20% сахарозы, гомогенизировали и затем центрифугировали в течение 20 мин. при 8000 g. Пробы содержащего Смесь белков супернатанта переносились в лунки на гелевой пластине.
Рис. 6.1. Места сбора проб сиговых рыб: 1 – p. Нева; 2 – оз. Ладожское; 3 – оз. Онежское; 4 – оз. Ладмозеро; 5 — оз. Лоухское; 6 — оз. Кереть; 7 – оз. Пулонгское; 8 – Кандалакшский залив; 9 – р. Северная Двина; 10 — водоемы Беломорско-Кулойского плато (реки Зимняя Золотица, Мегра, озера Западные Мегорские, Большое Восточное, Черное, Ернозеро, Волчьи); 11 – р. Мезень; 12 – р. Волонга; 13 – р. Печора; 14 – Печорское море; 15 – p. Обь; 16 –р. Сыня; 17 –р. Северная Сосьва; 18 –р. Лена; 19 — р. Колыма; 20 – оз. Байкал
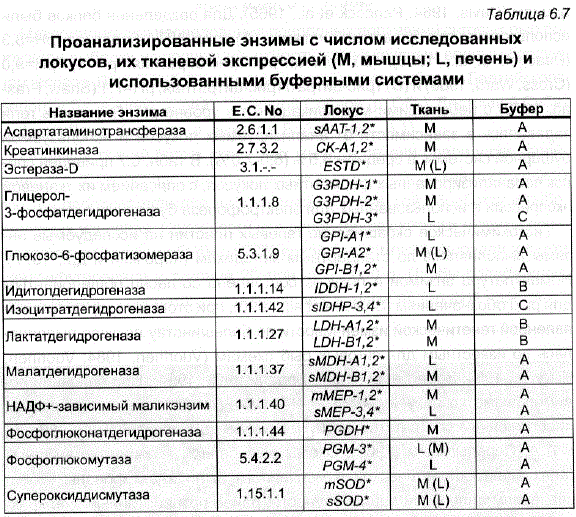
Электрофорез выполнялся на полиакриламидных гелях в камерах конструкции Поспелова (Кирпичников, 1979) согласно общим рекомендациям (Davis, 1964; Peacock et al., 1965). Для разделения белков были использованы три буферные системы: (А) трис-ЭДТА-боратная, рН=8,3 (Peacock et al., 1965), (В) трис-цитрат/трис-боратная, рН=8,0/pH=9,0 (Cross, Ward, 1980) и (С) трис-цитрат/трис-цитратная, рН=7,1 (Shaw, Prasad, 1970) с небольшими модификациями в уровне рН. Плотность геля задавалась в зависимости от анализируемых локусов и используемой буферной системы, в среднем 6,5% (6,0-7,0%). В табл. 6.7 приведен список проанализированных ферментных локусов, с описанием их тканевой экспрессии и использованных для электрофореза буферных систем.
Гистохимическое окрашивание гелевых пластин на исследуемые энзимы выполнялось по стандартным методикам (Корочкин и др., 1977). Номенклатура энзимов и локусов составлена согласно общепринятым для рыб обозначениям (Shaklee et al., 1990), при этом интерпретация выявленной генетической изменчивости по большинству локусов выполнялась по известным для сиговых рыб схемам (Vuorinen, 1984; Vuorinen, Pironen, 1984; Bodaly et al., 1991; Бодали и др., 1994). При описании полиморфизма по локусам ѕМЕР-3,4* и сK-A1,2* использовались схемы, предложенные соответственно Л.Н. Ермоленко с соавторами (1988а, б) и А. А. Перелыгиным (1988). Схемы выявленной в полиакриламидных гелях электрофоретической изменчивости были адаптированы к обозначениям аллельной вариабельности, ранее разработанным для крахмальных носителей и широко используемым в современной номенклатуре, принятой для сиговых рыб (Bodaly et al., 1991; Бодали и др., 1994). Привлеченные к настоящему исследованию первичные биохимические данные А.А. Перелыгина (1988) и Л.Н. Ермоленко (1989а) интерпретированы в соответствии с современной номенклатурой.
Статистическая обработка электрофоретических данных выполнена стандартными способами при помощи компьютерной программы BIOSYS-1 (Swoffоrd, Selander, 1981). В случаях полиморфизма обоих изолокусов применялась компьютерная программа ISOLOCI (Waples, 1988), когда предполагается равенство частот аллелей дуплицированных локусов. Определены аллельные частоты полиморфных локусов (Pos) и уровни ожидаемой гетерозиготности (H). Для построения дендрограмм применен метод UPGMA-кластеризации по величинам генетических расстояний D(Nei, 1978).
Таблица 6.7 Проанализированные энзимы с числом исследованных а локусов, их тканевой экспрессией (M, мышцы; L, печень) и не использованными буферными системами