Глава 3
Формирование линии половых клеток в период эмбрионального развития сиговых рыб
3.1. Цитоморфологические модификации первичных гоноцитов
У эмбрионов сиговых рыб первичные половые клетки в процессе миграции в область половых зачатков претерпевают определенные морфологические преобразования. У разных видов эти особенности ППК в той или иной степени различаются. Рассмотрим ранние этапы гаметогенеза у наиболее известного и многочисленного представителя сиговых рыб Сибири — пеляди.
Ниже приводим описание последовательных стадий формирования фонда первичных гоноцитов у эмбрионов озерной пеляди, интродуцированной в водоёмы Южного Урала (Челябинская область, Аракульский рыбоводный завод).
Как и у остальных костистых, яйцеклетки сиговых рыб относятся к полилецитальному типу с дискоидальным дроблением. У эмбрионов пеляди борозда первого деления дробления формируется через 20–22 ч после оплодотворения, или по методике учета возраста зародыша (Детлаф, Детлаф, 1960) — 2t°, соответствующее продолжительности двух митотических циклов в период синхронных делений дробления [Ротт, 1987]. Через 6 сут после оплодотворения при среднесуточной температуре инкубации в этот период +1,2 °С эмбрионы находились на стадии асинхронных делений дробления.
К 26 сут, на 15 стадии, перед закрытием «желточной пробки», у эмбриона отмечается от 6 до 8 дифференцирующихся сомитов. Эпиболия завершается, нервная пластинка, хорда, мезодермальные тяжи и энтодермальный пласт к этому моменту уже оказываются сформированными. Начинают формироваться зачатки глазных пузырей, однако отделы головного мозга ещё не дифференцированы.
На данной стадии развития у эмбрионов пеляди выявляются первичные гоноциты, которые располагаются среди клеток формирующихся спланхнотомов. Незначительное их количество, в среднем на один эмбрион приходилось 0,4 ППК (табл. 1 Приложения), объясняется трудностью их идентификации в массе недифференцированных клеток мезодермы, с которыми они обладают большим сходством.
На 34 сут эмбрионального развития продолжается формирование глазных бокалов. Нервная пластинка преобразована в нервный тяж, начинается становление отделов головного мозга. Клетки хорды вакуолизированы. Продолжается дифференциация миотомов, а внутри спланхнотомов появляются щелевидные полости. В процессе морфологических трансформаций зародыша несколько возрастает число первичных гоноцитов и изменяется их расположение: большая часть ППК выявляется среди клеток спланхнотомов, но каждый пятый гоноцит уже локализовался на перибласте, вблизи формирующихся нефротомов (табл. 1 Приложения).
На 60 сут эмбриогенеза зародыш охватывает до 3/4 желточного мешка, начинается пигментация глазных бокалов, дифференцируется головной мозг. Под хордой в сформированной спинной аорте присутствуют многочисленные гемоцитоблас28
ты — гемопоэтические стволовые клетки. Миграция первичных гоноцитов продолжается. На данной стадии только незначительная часть ППК ещё располагается среди клеток спланхнотомов (8,3 %), тогда как большее их количество концентрируется в области перибласта (75 %), а некоторые отмечаются под Вольфовыми протоками (16,7 %). Количество первичных гоноцитов также несколько возрастает (см. табл. 1 Приложения).
На 85 сут у эмбрионов глаза интенсивно пигментированы и сформирована плавниковая кайма. Продолжается формирование отделов головного мозга, дальнейшее усложнение среднего мозга и мозжечка. Клетки хорды полностью вакуолизированы и ядра в них почти не отмечаются. ППК локализовались отдельными группами в области спланхноплевры (68,7 %), а каждый третий уже достигал половых складок (табл. 1 Приложения). Некоторые первичные гоноциты в этой области полиморфноядерны.
К 118 сут объём желточного мешка у зародышей пеляди сокращается, продолжается пигментация тела, увеличиваются жаберные крышки и развивается челюстной аппарат. В еще большей степени возрастают размеры мозжечка, хорошо развиты отделы сердца. Усложняется морфология желудочно–кишечного тракта: во всех отделах кишечника хорошо развита полость, возрастает складчатость слизистой, формируется печень. Количество ППК увеличивается, но большая часть этих клеток (37,5 %) отмечается под Вольфовыми протоками, в области герминативных валиков локализуется 34,4 % первичных гоноцитов.
Таким образом, если у 26-суточных (16,2 градусо-дней) зародышей пеляди первичные половые клетки обнаруживаются по характерным морфологическим признакам на начальной стадии сомитогенеза среди клеток спланхнотомов, то по мере дальнейшего развития эмбрионов локализация ППК изменяется. Уже в 34 сут часть первичных гоноцитов располагается в области перибласта, а на стадии пигментации глазных бокалов некоторое их количество мигрирует под Вольфовы протоки. В области половых складок первые ППК появляются в 85 сут. В течение эмбриогенеза отмечается постепенное увеличение числа первичных половых клеток, как представляется, не вследствие типичного митотического деления, поскольку картин митозов не было выявлено, а по причине более отчетливого их распознавания среди дифференцирующихся соматических клеток и, вероятно, описанной выше пролиферации по типу полиплоидизирующего митоза.
В целом, общее количество ППК у эмбрионов в условиях Аракульского рыбоводного завода даже на этапе вылупления было незначительным по сравнению с их числом у пеляди в естественном ареале. По-видимому, это обусловлено длительной практикой близкородственных скрещиваний при искусственном разведении, т.к. установлено [Андрияшева, Черняева, 1985], что у пеляди уже первого поколения инбридинга существенно снижается онтогенетический гомеостазис, что в нашем исследовании могло привести к угнетению генеративной функции, проявлявшейся в сокращении количества ППК.
В дальнейшем анализ цитоморфологических особенностей первичных гоноцитов у эмбрионов сиговых рыб из естественного ареала проводили на материале, полученном на Абалакском рыбозаводе (г. Тобольск), куда на стадии бластуляции эмбрионы были доставлены с мест сбора икры на севере Тюменской области (р. Северная Сосьва и р. Обь). Термальный режим в инкубационном цехе также соответствовал динамике температуры воды в природных условиях естественного ареала сиговых рыб (рис. 3).
Пелядь. Через 72 сут после оплодотворения, к началу пигментации глаз, первичные гоноциты локализовались в зоне половых зачатков. ППК были неровной, лопастевидной формы, отмечались и полиморфноядерные клетки (рис. 4 а); изредка встречалисьсинцитиальные структуры, количество ядрышек варьировало от 1 до 4. Спустя 10 сут размеры клеток и ядер практически не изменялись (табл. 2
Приложения), доля гоноцитов с полиморфными ядрами возрастала, митозы появлялись редко и синцитии почти не выявлялись (табл. 3 Приложения).
На 97 сут зародышевого развития число ППК увеличивалось, они становились более округлыми и крупными, с 1–3 ядрышками в ядре. Доля первичных гоноцитов в составе синцитиев снижалась незначительно, а у половины исследованных эмбрионов отмечали по одному митозу ППК (рис. 4 б). У зародышей в 113 сут (рис. 5 а) количество первичных гоноцитов сокращалось, то же было отмечено и для полиморфноядерных клеток, но увеличивалась доля синцитиальных структур. В 128 cут вновь отмечено возрастание числа ППК и снижение доли полиморфноядерных клеток (табл. 3 Приложения).
В половых зачатках встречались синцитиальные образования и единичные митозы. При вылуплении у предличинок несколько сокращалось общее количество первичных гоноцитов, но возрастало число полиморфноядерных ППК и синцитиев при полном отсутствии митозов (табл. 3 Приложения). При этом размеры гоноцитов значительно увеличивались, что соответственно сопровождалось снижением ядерно-цитоплазматического отношения (табл. 2 Приложения).
Таким образом, у зародышей пеляди с начала пигментации глаз число ППК варьировало, оставаясь почти на одном уровне до вылупления. Соответственно, достигающее 30 % и более число полиморфноядерных клеток к концу эмбриогенеза
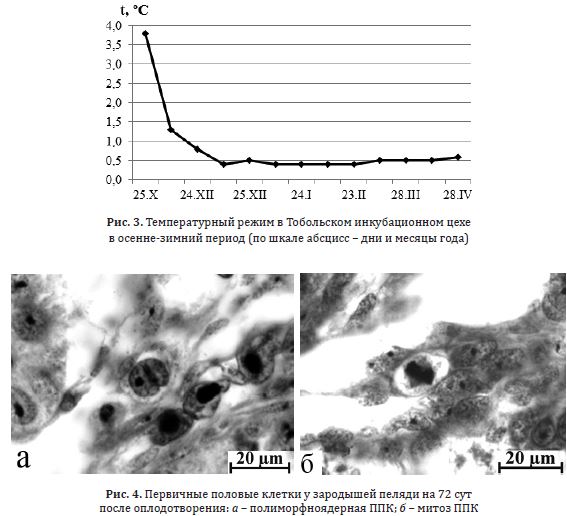
Рис. 3. Температурный режим в Тобольском инкубационном цехе
в осенне-зимний период (по шкале абсцисс – дни и месяцы года)
Рис. 4. Первичные половые клетки у зародышей пеляди на 72 сут
после оплодотворения: а – полиморфноядерная ППК; б – митоз ППК
уменьшалось; при этом возрастала доля синцитиев, находившихся в обратном соотношении с числом митозов, несколько сокращалось количество ядрышек.
Резюмируя вышеизложенное, отметим, что при сравнительно невысоком числе первичных гоноцитов у пеляди во вторую половину эмбриогенеза, их цитоморфологические показатели характеризуются слабо выраженными изменениями в динамике количества, полиморфноядерности и числе клеток в составе синцитиальных образований.
Тугун. Этот вид отличается наиболее продолжительным периодом эмбрионального развития. Наше исследование было начато в 130 сут после оплодотворения, когда 23,1 % ППК находились в составе синцитиев (табл. 4 Приложения), а в их цитоплазме наблюдались оптически плотные скопления. Митозы ППК на этой стадии не обнаруживались. На 141 сут значительно возрастало количество первичных гоноцитов, почти половина которых (42, 2 %) находилась в составе синцитиальных структур (рис. 6 а). Встречались многоядерные, пролиферирующие (рис. 6 б) и полиморфноядерные ППК (рис. 6 в), редкие митозы. К 155 сут количество половых клеток сокращалось, уменьшалось число синцитиев, но возрастала доля одиночных и полиморфноядерных гоноцитов (табл. 4 Приложения), т.е. просматривается обратная зависимость между этими состояниями. Общее количество ППК и первичных гоноцитов в составе синцитиев у эмбрионов тугуна спустя 171 сут после оплодотворения продолжало снижаться ( табл. 4 Приложения).
Незадолго до вылупления у зародышей в 186 сут количество первичных гоноцитов сокращалось до наименьшей за анализируемый период величины. Доля одиночных ППК возрастала (табл. 4 Приложения), но почти не встречались полиморфноядерные и двухъядерные клетки. Первичные гоноциты были округлой формы, 1–2 крупных ядрышка располагалось в центре ядра (табл. 2 Приложения, рис. 6 г). На этапе вылупления количество ППК достоверно (p <0,001) возрастало и значительно повышалось их число в синцитиях (табл. 4 Приложения), а доля многоядерных клеток была наибольшей за весь учитываемый период; митозы не выявлялись совсем. Возрастали размеры половых клеток, которые к концу эмбриогенеза у отдельных экземпляров достигали 28 μm и одновременно снижалось ядерно-цитоплазматическое отношение (табл. 2 Приложения).
Как можно видеть, в течение рассматриваемого периода динамика количества и цитоморфологических показателей первичных гоноцитов у эмбрионов тугуна проявлялась в бóльшем их числе и варьировании, чем у пеляди, в появлении
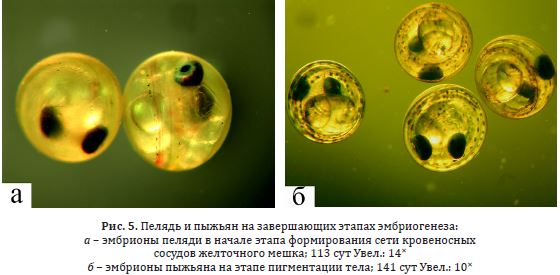
Рис. 5. Пелядь и пыжьян на завершающих этапах эмбриогенеза:
a – эмбрионы пеляди в начале этапа формирования сети кровеносных
сосудов желточного мешка; 113 сут Увел.: 14˟
б – эмбрионы пыжьяна на этапе пигментации тела; 141 сут Увел.: 10˟
многочисленных синцитиальных образований. Количество одиночных клеток значительно возрастало к концу эмбриогенеза, тогда как доля полиморфноядерных ППК и гоноцитов в составе синцитиев характеризовались обратной зависимостью. На этапе вылупления вновь повышалась доля клеток в синцитиальных комплексах.
Таким образом, у сигов-планктофагов, к которым можно отнести пелядь и тугуна, с начала пигментации глаз до вылупления формирование линии половых клеток существенно различается. Эти различия касаются количественной динамики ППК, их цитоморфологии, межклеточных взаимосвязей и характера пролиферативной активности. У тугуна количество первичных гоноцитов, полиморфноядерных, многоядерных ППК и клеток в составе герминативных синцитиев намного превышает эти показатели у пеляди. Такая особенность гаметогенеза является видоспецифической и, очевидно, отражает форсированный характер в развитии репродуктивной системы у этого короткоциклового вида.
Далее проследим начальные этапы формирования фонда первичных гоноцитов у сигов-бентофагов — пыжьяна, муксуна и чира — и сопоставим с полученными данными у пеляди и тугуна.
Пыжьян. У зародышей этого вида в 115 сут после оплодотворения первичные гоноциты локализовались в области половых валиков. Одиночные ППК имели овальную форму с неровными краями; хроматин был распределен по всему объему
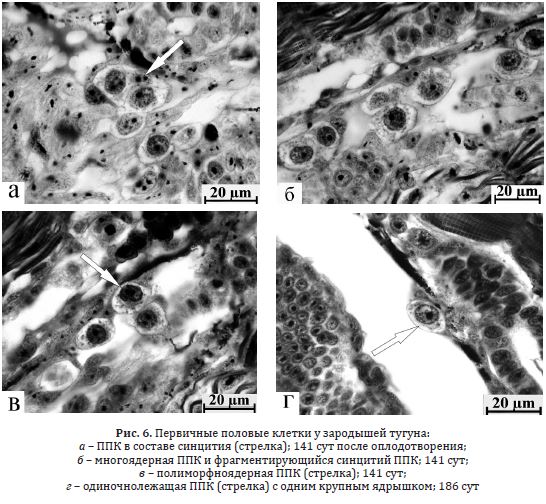
Рис. 6. Первичные половые клетки у зародышей тугуна:
а – ППК в составе синцития (стрелка); 141 сут после оплодотворения;
б – многоядерная ППК и фрагментирующийся синцитий ППК; 141 сут;
в – полиморфноядерная ППК (стрелка); 141 сут;
г – одиночнолежащая ППК (стрелка) с одним крупным ядрышком; 186 сут
ядра, в котором отмечали от 1 до 4 ядрышек (табл. 5 Приложения). Встречались также двухъядерные (рис. 7 а), множество полиморфноядерных ППК и фрагментирующиеся синцитии (табл. 6 Приложения).
К 126 сут общее число полиморфноядерных и в составе синцитиальных образований ППК снижалось, появлялись двухъядерные первичные гоноциты. В 142 сут у зародышей на этапе пигментации тела (рис. 5 б) число ППК незначительно увеличивалось, возрастали размеры клеток и ядер (табл. 6 Приложения). В ядре обычно встречались 2 ядрышка (рис. 7 б), реже — 1 или 3. Сокращалась доля полиморфноядерных клеток, но повышалось их число в составе синцитиев (табл. 6 Приложения). Спустя 158 сут после оплодотворения вновь отмечали снижение количества ППК; их размеры также уменьшались при соответственно возросшем ядерно–цитоплазматическом соотношении. В ядре 2-3 ядрышка, реже 1 или 4. Сокращалось количество полиморфноядерных ППК и их доля в синцитиях (табл. 6 Приложения). Митозы встречались крайне редко.
Незадолго до вылупления, в 172 сут, было отмечено очередное повышение количества ППК; в ядре чаще встречалось 2 ядрышка, реже 1 или 3 (табл. 5 Приложения). Возрастала доля полиморфноядерных ППК при полном отсутствии многоядерных клеток и митозов.
На этапе вылупления (181 сут) появлялись двухъядерные первичные гоноциты, доля ППК в составе синцитиев оставалась прежней. Размеры самих клеток и их ядер возрастали, но при этом ядерно-цитоплазматическое соотношение было смещено в направлении цитоплазмы (табл. 5 Приложения).
Таким образом, у эмбрионов пыжьяна в течение исследуемого периода при сравнительно невысокой вариабельности числа первичных гоноцитов полиморфноядерные ППК встречаются постоянно, как и половые клетки в составе герминативных синцитиев, а митозы редки.
Следует заметить, что для зародышей пыжьяна, начиная со стадии пигментации глаз, характерно низкое количество ППК, значительно варьирующие у разных особей соотношение одиночных клеток и синцитиальных образований, а при завершении эмбрионального периода — снижающиеся полиморфноядерность и митотическая активность.
Муксун. У зародышей муксуна через 96 сут после оплодотворения ППК находились в области половых валиков. Часть половых клеток имела полиморфные ядра, также отмечались многоядерные ППК (рис. 8 а, б) и сгруппированные в синцитиальные комплексы (рис. 8 в). Цитоплазма первичных гоноцитов на данной
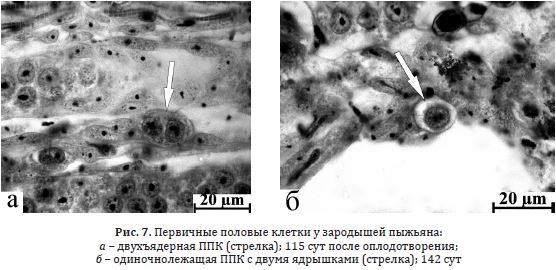
Рис. 7. Первичные половые клетки у зародышей пыжьяна:
а – двухъядерная ППК (стрелка); 115 сут после оплодотворения;
б – одиночнолежащая ППК с двумя ядрышками (стрелка); 142 сут
стадии имела низкую оптическую плотность, а количество ядрышек в их ядрах не превышало 2-3 (табл. № 5 Приложения). Через десять суток количество ППК увеличивалось с одновременным снижением доли клеток с полиморфными ядрами, хотя степень полиморфии ядер возрастала. Уменьшались размеры клеток и отмечались митозы (табл. 5, 7 Приложения). В 120 сут после оплодотворения вновь было отмечено повышение количества и размеров ППК, возрастание размеров ядер и сокращение доли полиморфноядерных клеток. Число половых клеток на 136 сут еще более возрастало, а доля полиморфноядерных ППК продолжало снижаться. Через 151 сут после оплодотворения процесс сокращения количества первичных гоноцитов продолжался и одновременно возрастала доля одиночных клеток (табл. 7 Приложения). У предличинок на этапе вылупления установлено максимальное число ППК и значительное их количество в составе синцитиальных образований; возрастало число полиморфноядерных клеток, появлялись митозы. Размеры первичных гоноцитов и их ядер к моменту вылупления увеличивались при неизменном ядерно-цитоплазматическом соотношении (табл. 5 Приложения).
Таким образом, у эмбрионов муксуна в процессе миграции в зачатки гонад первичные половые клетки претерпевают морфологические изменения, которые проявляются в периодически изменяющейся полиморфноядерности и сгруппированности в синцитиальные образования; встречающиеся при этом митозы очень редки. Первичные гоноциты характеризуются повышенной количественной и морфологической вариабельностью с тенденцией возрастания их числа к этапу вылупления.
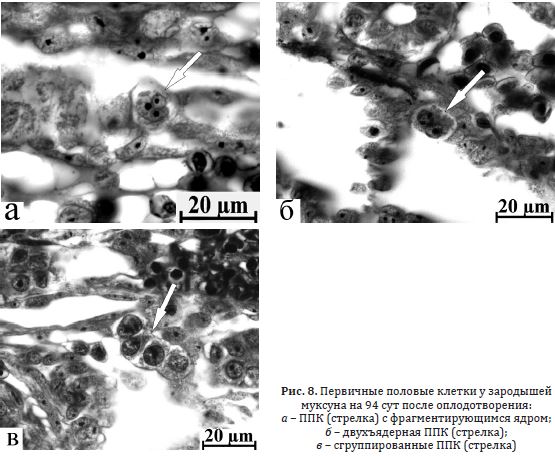
Рис. 8. Первичные половые клетки у зародышей муксуна на 94 сут после оплодотворения:
а – ППК (стрелка) с фрагментирующимся ядром; б – двухъядерная ППК (стрелка);
в – сгруппированные ППК (стрелка)
Чир. Первичные гоноциты у эмбрионов чира на 102 сут после оплодотворения находились под Вольфовыми протоками. Их цитоплазма имела низкую оптическую плотность, в больших пузыревидных ядрах число ядрышек варьировало от 1 до 4 (рис. 9 а). Присутствовали двухъядерные и полиморфноядерные ППК (рис.9 б), а также клетки в составе синцитиальных образований; ни у одного из проанализированных эмбрионов не было выявлено митотически делящейся ППК (табл. 8 Приложения). У зародышей в 113 сут по-прежнему отмечали полиморфноядерные, двухъядерные, фрагментирующиеся (рис. 9 в) и одиночные первичные гоноциты; встречались митозы (рис. 9 г), доля которых повышается к 128 сут при снижении общего числа ППК. Однако уже к 143 сут было отмечено возрастание числа ППК, увеличение доли полиморфноядерных клеток и первичных гоноцитов в составе синцитиев (табл. 8 Приложения); количество ядрышек составляло 1–5, изредка достигая 6 (табл. 5 Приложения). Продолжалось увеличение числа митозов. В 157 сут, на завершающих стадиях эмбрионального периода, снизившееся количество половых клеток совпадает со сходной динамикой полиморфноядерных ППК, снижалось и число гоноцитов в составе синцитиев (табл. 8 Приложения). В 164 сут после оплодотворения начинается вылупление предличинок. В этот период у них несколько возрастало количество ППК, хотя число полиморфноядерных первичных гоноцитов и клеток в составе синцитиальных образований не изменялось, митозы не выявлялись (табл. 8 Приложения). За вто
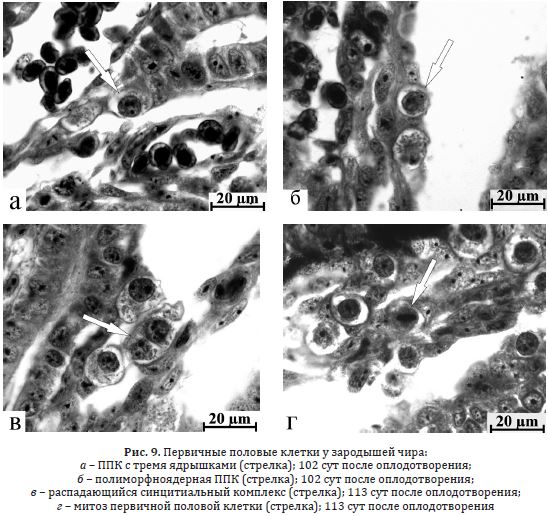
Рис. 9. Первичные половые клетки у зародышей чира:
а – ППК с тремя ядрышками (стрелка); 102 сут после оплодотворения;
б – полиморфноядерная ППК (стрелка); 102 сут после оплодотворения;
в – распадающийся синцитиальный комплекс (стрелка); 113 сут после оплодотворения;
г – митоз первичной половой клетки (стрелка); 113 сут после оплодотворения
рую половину эмбриогенеза значимых изменений в количестве и цитометрических показателях ППК у чира не было установлено (табл. 5 Приложения).
Таким образом, в эмбриогенезе чира при широком разбросе числа первичных гоноцитов (от 1 до 86) отмечается низкое варьирование их среднего значения. К концу эмбрионального периода снижаются число полиморфноядерных ППК и их доля в составе синцитиев, тогда как количество одиночных клеток возрастает.