Глава 1
Материалы и методы исследования
Сборы и анализ эмбрионов, личинок, мальков и сеголеток сиговых рыб проводились в период с 1983 по 2014 гг. [Селюков, 1989, 2012; Селюков и др., 2000, 2008].
Молодь пеляди ендырского происхождения (оз. Ендырь — в бассейне р. Иртыш) исследована в апреле-сентябре 1983-1985 гг. в ЦЭС ГосНИОРХ «Ропша» [Селюков, 1985, 1987]. В апреле 1987 г. в Тобольском инкубационном цехе (ТИЦ) зафиксированы на этапе вылупления и исследованы предличинки озёрной и речной пеляди, чира, сига-пыжьяна и муксуна. В декабре-мае 1996-1997 г. и феврале-мае 1998 г. в Аракульском инкубационном цехе (Челябинская обл.) изучали формирование ППК в эмбриогенезе озёрной пеляди [Селюков и др., 2000; Бондаренко, 2003]. Формирование линии половых клеток исследовали в 2000-2001 гг. и в 2004-2005 гг. – у эмбрионов пеляди, муксуна, чира, пыжьяна и тугуна [Селюков и др., 2010а, б]. В постэмбриональный период у предличинок, личинок и мальков этих видов анализировали ППК до их перехода к митозам, т.е. до 30-40 сут [Бондаренко, 2003; Вторушин, 2003].
С ноября 2010 г. по март 2011 г. на базе полигона водных биотехнологий биологического факультета Тюменского университета был поставлен эксперимент по влиянию фенола на эмбриогенез сига и его гибрида с рипусом. В 2008-2011гг. в бассейнах УЗВ полигона водных биотехнологий ТюмГУ содержали сеголеток тугуна, муксуна и сига, у которых изучали дифференцировку пола и начальные этапы формирования фонда половых клеток [Селюков и др., 2010 в; Ефремова, 2013].
Морфометрический метод
Для морфометрического анализа молодь сиговых рыб на этапе вылупления фиксировали в 2 %-ном растворе формальдегида и измеряли по 16 параметрам (рис. 1): L (или TL) — общая длина тела; L1 — длина тела до конца хорды; A — антеанальное расстояние; H — наибольшая высота тела; HM — наименьшая высота тела; CL — длина хвостового стебля; BS — наибольшая толщина тела; C — длина головы; R — длина рыла; OC — горизонтальный диаметр глаза; OP — заглазничное расстояние; OO — межглазничное расстояние; HC — наибольшая высота головы; PL — длина грудного плавника; LVS — длина желточного мешка; HVS — высота желточного мешка. Подсчитывали меланофоры на голове (mfc), желточном мешке (mfs), спинной (mfd) и брюшной (mfv) сторонах тела [Селюков и др., 2005; Бондаренко, 2003].
У сеголеток и двухлеток пеляди, тугуна, сеголеток муксуна и сига измеряли общую длину тела, длину тела по Смитту, общую массу тела и массу тела без внутренностей.
Гистологический метод
В качестве основного метода анализа был выбран гистологический как высокоинформативный, чувствительный и фотодокументальный. Наибольшее значение он имеет для диагностики состояний в онтогенезе и при изучении отклонений от нормального развития, позволяет оперативно установить характер и степень выраженности изменений на ранних стадиях развития патологий, а также
предоставляет детальную информацию для комплексной оценки протекающих в организме процессов.
Зародышей и личинок сиговых рыб фиксировали в смеси Буэна, реже — Карнуа, Бродского и 10 %-ном растворе формальдегида. Гистологический анализ проводили по стандартным методикам [Ромейс, 1953; Лилли, 1969; Микодина и др., 2009]. Препараты анализировали на микроскопе AxioImager A1 («Zeiss») при увеличениях 200×, 400× и 1000× с использованием лицензионного программного обеспечения AxioVision 4.7.1. («Zeiss»). Окрашенные срезы фотографировали видеокамерой AxioCam MRc5 («Zeiss»).
Для пространственной локализации первичных гоноцитов, а также ооцитов в начальный период формирования потенциальной плодовитости приготавливали 30-40 мкм срезы фиксированных в 10 %-ном растворе формальдегида зародышей (и гонад молоди) и после окраски акридиновым оранжевым анализировали на конфокальном лазерном сканирующем микроскопе LSM 510 META (Zeiss). Флуоресценцию возбуждали аргоновым лазером при длине волны 488 нм и гелий-неоновым лазером — при 543 нм (рис. 2).
Статистический анализ
По результатам учёта у зародышей сиговых рыб количества первичных гоноцитов и их ядрышек, измерений диаметра ППК, их ядер, ядерно-цитоплазматичес
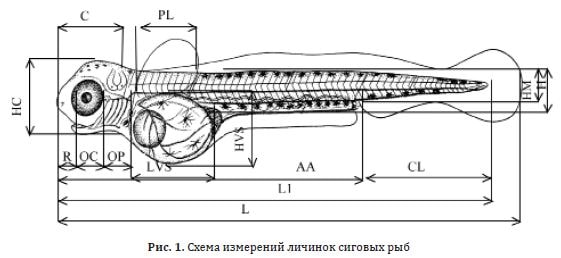
Рис. 1. Схема измерений личинок сиговых рыб
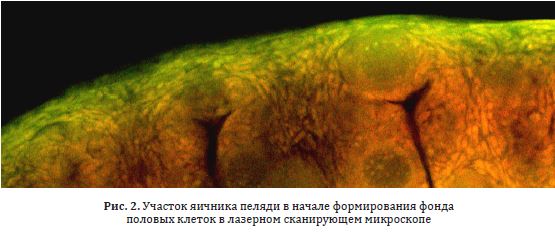
Рис. 2. Участок яичника пеляди в начале формирования фонда половых клеток в лазерном сканирующем микроскопе
кого отношения в период эмбрионального развития — пигментации глаз и начала формирования на желточном мешке сети кровеносных сосудов (с учетом τ0 — 60 % от продолжительности всего эмбриогенеза) — и на этапе вылупления проводили дискриминантный и кластерный анализы в пакете STATISTICA (6.0) [Боровиков, 2003].
Дискриминантный анализ проведен в полном варианте с включением всех переменных [Ивантер, Коросов, 2003; Пузаченко, 2004]. Оценку дистанции расстояний между цитометрическими параметрами ППК, степень их согласованного развития у разных видов сиговых рыб на тех же стадиях эмбриогенеза осуществляли с помощью кластерного анализа. С этой целью в рамках евклидовой метрики использовали двухсвязный парногрупповой метод (weighted pair group average) пакета STATISTICA, разработанного StatSoft, Inc. [Боровиков, 2003]. Методологическим основанием для проведения данного анализа в ихтиологических исследованиях послужила публикация В.Л. Андреева и Ю.С. Решетникова [1977].