11.5. Обнаружение и выделение гемопротеида цитохрома β560 в икре
C помощью спектрофотометрического обследования (применялись спектрофотометры
СФ?14, СФ?26, Beckman?35, Hitachi?557) живой икры севанского сига, байкальского омуля,
баунтовского сига и белорыбицы было установлено, что пигментация икры сиговых рыб
обусловлена наличием каротиноидных пигментов (максимумы поглощения 462 и 492 нм)
и гемопротеида с максимумами поглощения 428; 560 и плохо выраженным максимумом
в области 530 нм (рис. 80). Для изучения локализации пигментов в икре последняя, после
растирания в ступе с добавлением фосфатного буфера сахарозы, была разделена методом
центрофугирования гемогената на плазму, жировые капли и собственно желток.
Спектральный анализ плазменной части икры (в супернатанте) обнаружил незначи-
тельное содержание в ней каротиноидных пигментов. Максимумы поглощения света каро-
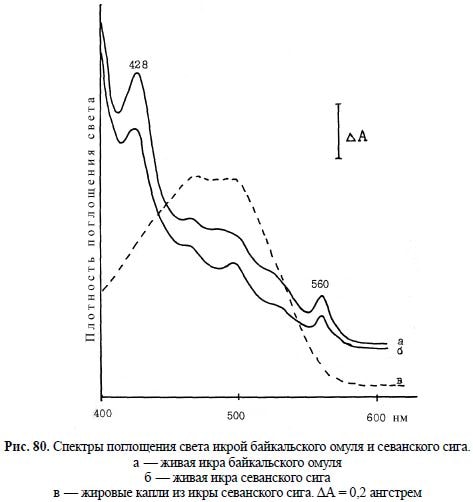
Рис. 80. Спектры поглощения света икрой байкальского омуля и севанского сига.
а — живая икра байкальского омуля
б — живая икра севанского сига
в — жировые капли из икры севанского сига. ?А = 0,2 ангстрем
тиноидными пигментами плазменной части икры баунтовского сига находились в области
428, 464 и 495 нм и полностью совпадали с максимумами поглощения каротиноидов живой
икры (462, 492 нм). Первый максимум не выявлялся из-за наложения спектра гемопротеида
и большого наклона спектра, вызванного значительным рассеиванием света. В плазменной
части икры нами обнаружены в небольшом количестве каротиноидные пигменты.
Спектры собственно желтка показали максимумы, характерные для гемопротеидов,
а также слабо выраженные каротиноидные максимумы (рис. 81). Для выяснения природы
каротиноидных пигментов, содержащихся в самом желтке было проведено высаливание
белков сульфатом аммония (Микулин, 1978). Полученные после высаливания спектры
супернатантов желтков сиговых рыб показали отсутствие в них белково-каротиноидных
комплексов, характерных для икры большинства лососёвых рыб. Обнаруженные на спек-
трограмме в водорастворимой части желтка каротиноиды, вероятно, были растворены
в мельчайших каплях жира.
В желтке был обнаружен пигмент некаротиноидной природы, а именно водораство-
римый гемопротеид, принятый нами сначала ошибочно за цитохром «О»-типа (Черняев,
Арцатбанов, Микулин, Валюшок, 1987; Черняев и др., 1988). Позднее были приняты во
внимание возражения А. А. Нейфаха, указывавшего на невозможность нахождения дан-
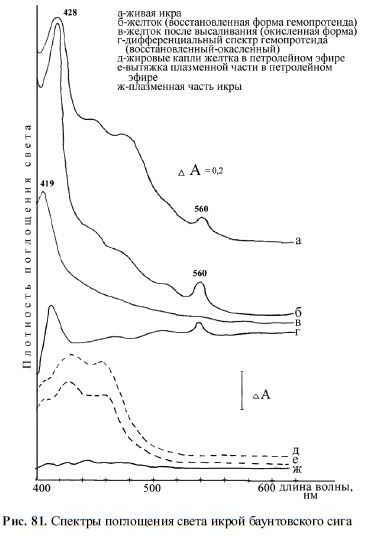
Рис. 81. Спектры поглощения света икрой баунтовского сига
227
ного водорастворимого гемопротеида в желтке яиц рыб в растворённом состоянии. Ци-
тохром «О» является самой распространенной оксидазой бактерий (Jurtshuk, Yang, 1960;
Pool, 1983) и встречается у некоторых эукариотических микроорганизмов — трипанозом
(Perlish, Eichel, 1971 и др.). Данные о цитохроме «О» в организмах и яйцах рыб в литера-
туре отсутствуют.
Обнаруженный нами гемопротеид был идентифицирован как цитохром ?560, т. к. при
комнатной температуре ?-максимум дифференциального спектра восстановленного ге-
мопротеида находился в области 555–565 нм, ?-максимум — в области 427–432 нм и ме-
нее выраженный ?-максимум — в области 520–525 нм (рис. 79–82). Соотношение между
главными максимумами ?: ? = (7–9):1 (Wood, 1984).
Цитохромами называют группу гемопротеидов, у которых атом железа, входящий
в состав их гема, как и у гемоглобина, легко подвергается обратимому окислению и вос-
становлению (Бриттон, 1986). Данное свойство многим цитохромам придаёт очень важ-
ное биологическое значение в переносе электронов. Однако обнаруженный нами у сигов
в желточном мешке цитохром ?560 является водорастворимым и, следовательно, участво-
вать в переносе электронов в дыхательной цепи не способен.
Цитохромы содержатся в тканях всех животных, растений и в аэробных микроорга-
низмах. В настоящее время известно довольно много детально изученных цитохромов,
которые по природе содержащейся в них простетической группы и способа связи с бел-
ками разделены на четыре главные группы: цитохромы а, b, с, d. Простетическая группа
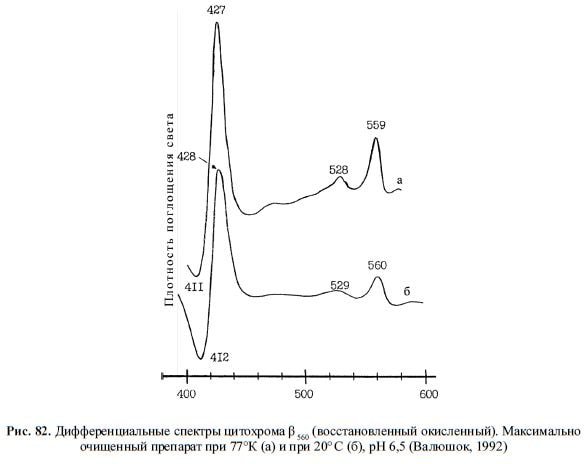
Рис. 82. Дифференциальные спектры цитохрома ? 560 (восстановленный окисленный). Максимально
очищенный препарат при 77°К (а) и при 20° C (б), рН 6,5 (Валюшок, 1992)
228
цитохрома b-типа, обнаруженная нами в икре сиговых рыб (Черняев и др., 1988 а), пред-
ставляет собой протогем IX (рис. 83).
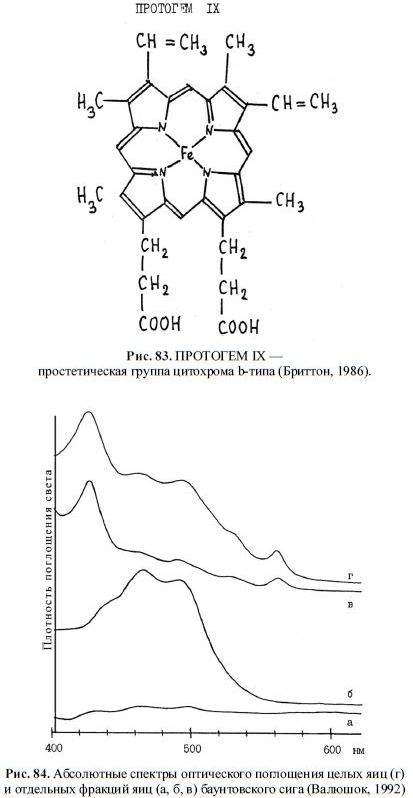
Рис. 83. ПРОТОГЕМ IX —
простетическая группа цитохрома b-типа (Бриттон, 1986).
Рис. 84. Абсолютные спектры оптического поглощения целых яиц (г)
и отдельных фракций яиц (а, б, в) баунтовского сига (Валюшок, 1992)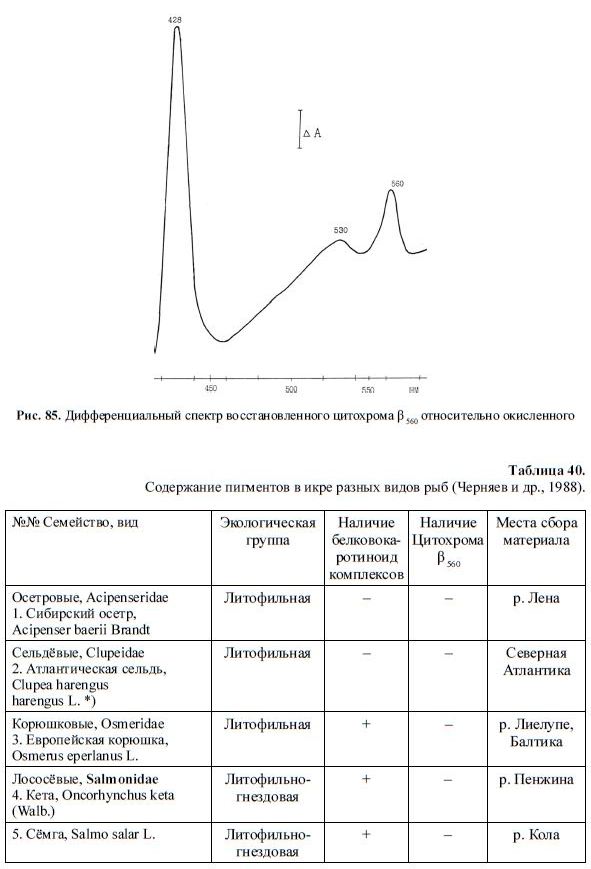
Рис. 85. Дифференциальный спектр восстановленного цитохрома ? 560 относительно окисленного
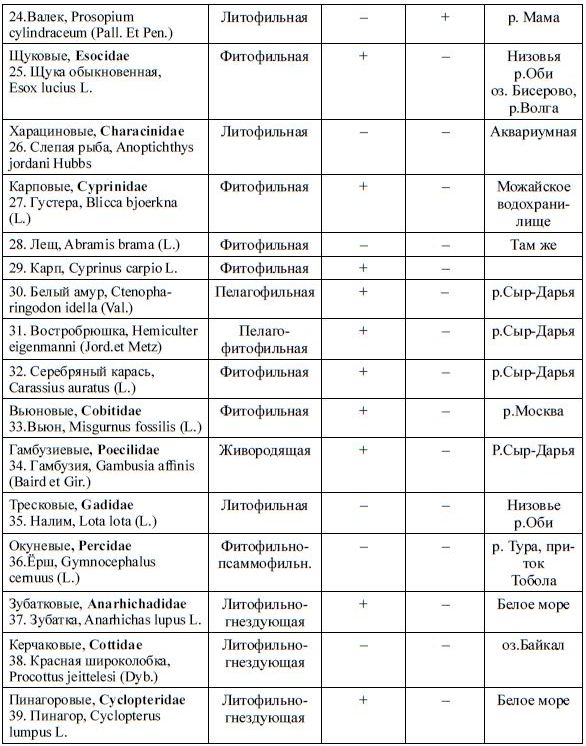
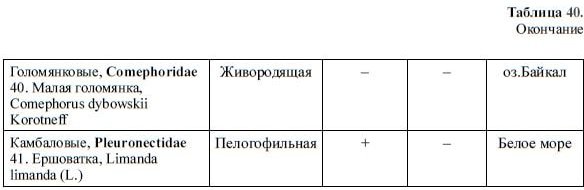
Таблица 40.
Содержание пигментов в икре разных видов рыб (Черняев и др., 1988).
Таблица 40.
Продолжение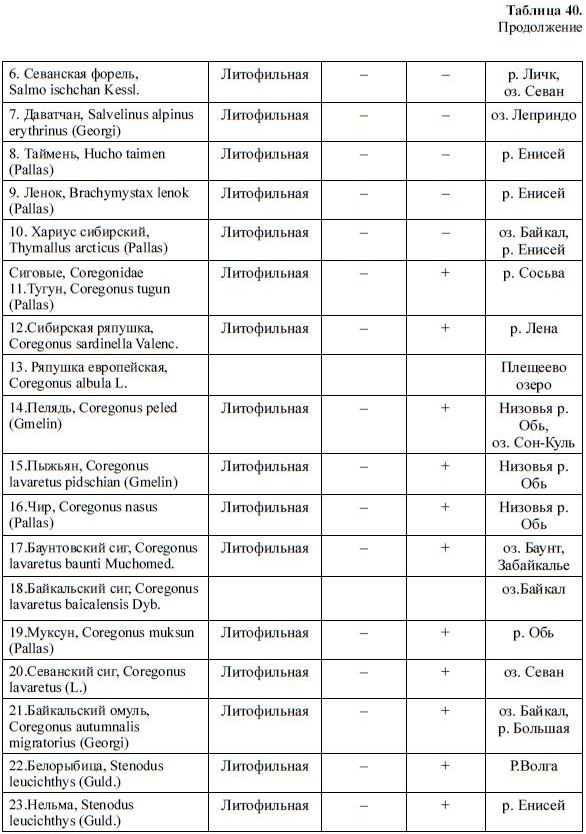
От остальных цитохромов b-типа описанный нами цитохром отличается способно-
стью образовывать устойчивые комплексы с ингибиторами дыхания СО и CN (Jurtshuk,
Yang, 1960; Pool, 1983). СО-комплексы фермента диссоциируют под воздействием света,
после чего цитохром снова способен взаимодействоватъ с кислородом, что подтверждает
его оксидазную функцию (Саstor, Chance, 1959).
Цитохромы b-типа, как правило, являются интегральными мембранно связанными
белками, что и определяет трудности их изолирования и очистки. К настоящему времени
лишь немногие цитохромы этого типа удалось очистить до гомогенного состояния.
В восстановленном состоянии цитохром ?560 связывается с окисью углерода, образуя
комплексы, дифференциальные спектры которых имеют в ?-полосе основной максимум
в 565–558 нм и минимум в 547–560 нм. В ?-полосе максимум наблюдается при 535–539
нм, а в хорошо выраженой полосе Соре максимум при 412–420 нм, минимум же при 428–
432 нм (Jurtshuк, Yang, 1960; Choс, Webster, Сanghey, 1982; Pool, 1983; Baines, Hubbard,
Pool, 1983; Wood, 1984). В окисленном состоянии цитохром b-типа реагирует с CN, и об-
разует устойчивые комплексы, которые восстанавливаются дитионитом (Appleby, 1969).