8.4. Воздействие отрицательной температуры на эмбриогенез
Для выяснения воздействия отрицательных температур на икру сиговых рыб (Черня-
ев, 1971; Tcherniaev, 1977) были проведены опыты с икрой байкальского омуля на этапе
образования подвижного жаберно-челюстного аппарата (120 суток развития). Две серии
экспериментов с быстрым и медленным замораживанием икринок в лабораторных тер-
мо-электрических микрохолодильниках (ТЛМ) были осуществлены в интервалах отри-
цательных температур 0° — –2?С, —2° — –4?С и –4° — –6° C с выдержкой на заданной
температуре в 2 часа. После оттаивания на следующие сутки икра просматривалась под
микроскопом. Опыты показали, что при медленном замораживании (выход на заданные
температуры составил 1,5 часа) уже при –2° C наступила гибель значительной части икры
(84,8%), а при –4° C гибель составляла 98–99%. При снижении температуры до –6?С как
при быстром, так и при медленном замораживании произошла полная гибель зародышей
из-за выхода перивителлиновой жидкости при 0?С сквозь оболочку икры наружу.
При быстром замораживании (время выхода на заданную температуру составляло
менее I часа) выживаемость составила 100%. Объяснить это можно тем, что при быстром
замораживании до –2° и –4° C также наблюдается обезвоживание перивителлинового
пространства, но инкапсулирование в лёд наступает столь быстро, что оболочка икры
остается практически сферической, и она не соприкасается с телом эмбриона, что пре-
пятствует процессу обморожения. Температура же –6?С для икры и даже для подвижного
эмбриона является летальной (Черняев, 1971, 2004, 2013; Tcherniaev, 1977).
Анализ термограммы замораживания икры байкальского омуля в водной среде
(рис. 65) даёт полное представление о фазовых превращениях системы, происходящих
при её замораживании: степень переохлаждения воды (S), температуры начала (К, К?)
и окончания (Р, Р?) кристаллизации, её продолжительности (Т), наличия одного или не-
скольких температурных скачков. Время остановки и задержки снижения температуры
определяется не только точкой замерзания раствора, но и количеством замерзающей
воды и скоростью охлаждения. На термограмме хорошо видно, что после переохлаж-
дения перивителлиновой жидкости и последующего повышения температуры до точки
замерзания, при достижении температуры, соответствующей температуре депрессии (?),
происходит замерзание воды. Этот подъём, или температурный скачок, описанный у жи-
вотных впервые П. И. Бахметьевым в 1898 г., возникает в результате выделения тепла при
кристаллизации, которое продолжается до тех пор, пока не кристаллизуется вся вода,
способная превратиться в лёд при данной температуре. Серьёзный обзор исследований
по воздействию переохлаждения и замораживаний содержится в монографии Одри Смит
(1963), в которой эта англичанка проводила исследования протекторных свойств глице-
рина при консервации тканей и яиц животных различных систематических групп. Она
предполагала существование неких антифризных соединений, открытых позже Де Фри-
зом и его сотрудниками (De Vries et al, 1982).
Л. К. Лозина-Лозинский (1972) объясняет это явление следующим образом. Если при
достижении точки замерзания температура некоторое время остаётся постоянной, обра-
зуя «плато», то при этом сохраняется равновесие между жидкой фазой и образующимися
кристалликами с абсолютным преобладанием жидкой фазы. Организмы и их ткани на
этой стадии замерзания, как правило, не повреждаются. Жизнеспособность сохраняется
и после некоторого дальнейшего снижения температуры объекта, т. к. не вся вода сразу
превращается в лёд. Конец «плато» еще не означает окончания процесса кристаллизации.
Это обуславливается тем, что количество образующегося в организме или тканях льда
является функцией температуры, и только охлаждение до –20–30° C вызывает замерзание
почти всей массы способной к замерзанию воды (Moran, 1926).
При переходе температуры воды вокруг икринки из положительных значений в отри-
цательные, из-под оболочки икры в окружающее икринку водное пространство начина-
ется отток воды, что приводит к обезвоживанию перивителлиновой жидкости. Согласно
E. Ohtsuka (1958) и А. И. Зотину (1961), перивителлиновая жидкость содержит ряд ами-
нокислот: цистин, тирозин, лизин, глютаминовую и аспарагиновую кислоты, аргинин
и лейцин, однако нельзя приписывать белкам значительную роль в создании тургора.
Перивителлиновая жидкость представляет собой гидрофильный коллоид, содержащий
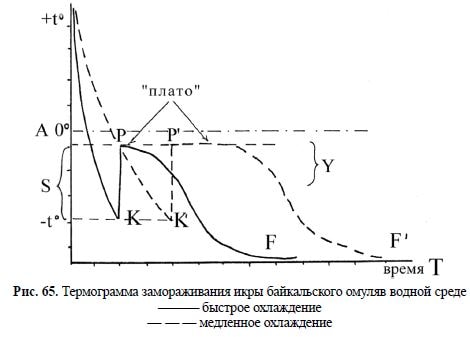
Рис. 65. Термограмма замораживания икры байкальского омуляв водной среде
——— быстрое охлаждение
— — — медленное охлаждение
155
полисахариды (галактозу, маннозу и сахара), идентифицированные по цитохимическим
реакциям как мукополисахариды. Таким образом, потеря воды перивителлиновой жидко-
стью под воздействием отрицательных температур вызывает повышение концентрации
в ней веществ, главным образом полисахаридов, что приводит в свою очередь к сниже-
нию температуры её точки замерзания.
При медленном замораживании процесс обезвоживания икры происходит быстрее,
чем инкапсулирование икры в образующийся кругом лёд в момент кристаллизации
водной среды. Вследствие значительного обезвоживания перивителлинового простран-
ства оболочка икры сморщивается и соприкасается с телом зародыша, обжимая его. По-
сле оттаивания икры части тела эмбриона, соприкасавшиеся с оболочкой, носят следы об-
морожения, особенно головной отдел и хвост, что и приводит к полной гибели икры. Этот
эффект также был отмечен О. Смит (1963) при нахождении перемороженных рыб в ёмко-
сти вместе со свежевыловленными: в местах соприкосновения тел произошла кристалли-
зация окружающей воды и замерзание (витрификация) тканей рыб. Очень примечателен
приводимый этим автором, со ссылкой на работы П. Ф. Шоландера (Scholander P. F. et al.
1953), факт полного промерзания чёрных щук (Dallia pectoralis). В 1886 г. Тернер описал,
как однажды в экспедиции на Аляске он накормил ездовых собак мелкими чёрными щу-
ками из вырубленных пешнями кусков льда, в котором они были вморожены в течение
нескольких недель. Вскоре собак вырвало оттаявшей и ожившей рыбой.
В серии опытов с быстрым замораживанием икры омуля процесс обезвоживания пе-
ривителлинового пространства также имел место, но кристаллизация воды и инкапсули-
рование икры в лёд наступали столь быстро, что оболочка икры оставалась почти круглой,
сохраняя в перивителлиновом пространстве достаточное количество жидкости, которое
препятствовало соприкосновению оболочки и тела эмбриона. Вероятно, на данном этапе
развития икры омуля летальная температура –6° C соответствует наблюдаемой в природе.
В естественных условиях переход икры в состояние «пагона» происходит раньше — на
этапах дробления и гаструляции, когда тургор у икры наивысший, и она выдерживает
нагрузку на раздавливание до 1,5 кг у омуля и 2,5 кг у сига. Описываемые исследования
проводились на икре омуля, у которой, ввиду действия фермента вылупления гиалуро-
нидазы на этапе образования эмбриональной системы кровообращения, прочность обо-
лочки не превышала 1,0 кг. Кроме того, на этапах дробления, бластулы и органогенеза
у зародышей нет значительно выступающих частей, которые могли бы быть подвергнуты
обжиму первичной оболочкой икры и обморожению. Возможно, на этих этапах развития
икра омуля и сига выдерживает и более низкие температуры.
Согласно исследованиям Л. К. Лозина-Лозинского (1972), в биологических системах
существуют механизмы, предотвращающие повреждающее действие отрицательных
температур. В икре сиговых рыб, в частности, омуля, развивающейся при отрицательных
температурах в состоянии «пагона» могут иметь место следующие процессы и механизмы.
В случае чрезвычайно высокой вязкости биологических жидкостей, например, при
большой потере воды у организмов, ткани которых адаптированы к дегидратации, тем-
пература кристаллизации находящейся в тканях воды значительно снижается, а замер-
зание вообще может не наступить, и происходит переохлаждение. Очень важным при
этом является тот факт, что наружная кристаллизация наступает раньше, чем внутри
организма. Как правило, при быстром охлаждении очаги кристаллизации, образующи-
еся вне клеток или вне организма, ограничивают степень переохлаждения внутрикле-
точной протоплазмы.
156
У пресноводных животных осмотическое давление тканевых жидкостей всегда значи-
тельно превышает осмолярную концентрацию пресной воды, и они обладают регулятор-
ными механизмами, позволяющими им жить при разных осмолярных концентрациях вну-
три и вне тела (гипотонический тип осморегуляции). По данным Уммингера (Umminger,
1967), адаптация рыб к перенесению отрицательных температур, вероятно, происходит
так же, как у тропической карпозубой рыбки фундулюса (Fundulus heteroclitus), путем пе-
рестройки метаболизма под воздействием резкого повышения температуры при пересы-
хании водоёма. В результате этого в сыворотке крови происходит увеличение почти всех
компонентов: натрия — на 7,4%; кальция — на 43,8; магния — на 35,8; хлоридов — на
15,5; небелкового азота — на 41,3; общего холестерина — на 73,1%, кроме калия, бикар-
боната, неорганического фосфора и общего белка, количество же глюкозы увеличивается
в пять раз.
При изучении воздействия отрицательных температур на насекомых (Ушатинская,
1980) выявлено, что для того чтобы состояние переохлаждения у диапаузирующих на-
секомых стало устойчивым на молекулярном уровне должно произойти накопление
энергетических запасов — жиров, углеводов, белков и редукция количества воды в теле.
При похолодании перед зимовкой происходит трансформация части резервных жиров
в углеводы, увеличивается количество ненасыщенных жирных кислот. При температуре
близкой к 0° C в гемолимфе насекомых содержание глюкозы увеличивается, а у некото-
рых видов часть углеводов преобразуется в глицерин. Многие виды насекомых зимуют
на стадии богатого жиром яйца — наиболее устойчивой к переживанию недостатка тепла
и пищи (Ушатинская, 1960).
Исследования смертности энхитреид (Enchitreus albi) и дождевых червей (Lumbriculus
terrestris) установили, что сильные морозы в сочетании с бесснежной зимой уничтожили
в Финляндии популяцию почвообитащих олигохет. Однако их яйца выжили, и через два
года численность червей восстановилась (В. Хухта, 1980).
У зимующих в Финляндии лягушек С. Пасаненом (1980) было выявлено, что актив-
ность ферментов фосфорилазы и липазы-эстеразы в печени и жировых тканях осенью
и зимой очень низкая. Это указывает на то, что в этот период преобладает углеводный
обмен. В зимний период также происходит обезвоживание их организма. По данным
С. Х. Гузаировой и её коллег (1977), у зимующих лягушек в Якутии в этот период содер-
жание в тканях витамина С минимальное (за исключением печени). В то же время запасы
гликогена в печени и мышцах возрастают к зиме в 5 раз, по сравнению с началом лета
(июль) (Гузаирова и др., 1977).
Таким образом, в случае дегидратации организма во время его активного состояния,
повреждения возникают на организменном или надклеточном уровне. При этом, с одной
стороны, нарушается обмен веществ, а с другой, происходит необратимая потеря воды,
тогда как в случае замерзания (в воде) большая часть воды после таяния снова всасывает-
ся клетками и соединяется с протоплазмой. Л. К. Лозина-Лозинский (1972) подчеркивает,
что яйца рыб и птиц чувствительны к отрицательным температурам, так как в желтке со-
держится большое количество липопротеиновых комплексов. Например, лецитовителлин
куриного желтка чувствителен к замораживанию при –3° C. Однако, дегидратация, кото-
рую мы наблюдаем у яиц сиговых рыб, вероятно, способствует повышению устойчивости
к замораживанию липопротеинового комплекса (Черняев, 2004, 2013).
При замораживании икры омуля, в зависимости от скорости этого процесса, согласно
Л. К. Лозино-Лозинскому (1972), происходит кристаллизация внеклеточной и внутрикле-
точной воды. Однако механизмы, способствующие устойчивости к состоянию переох-
157
лаждения, препятствуют образованию в тканевых жидкостях эмбриона зародышей кри-
сталлов — нуклеусов. Форма кристаллов льда варьирует в зависимости от температуры
и скорости охлаждения, а также от состава раствора. Наиболее быстрый рост кристаллов
происходит в направлении более разбавленного вещества. Вероятно, в связи с этим в био-
логических системах, имеющих гетерогенный характер, происходит неодновременное
замерзание и образование разных по величине температурных скачков с неодинаковыми
точками замерзания.
Описывая механизм кристаллизации льда, Т. В. Одрова (1975) приводит следующие
сведения: «При понижении температуры более плотная структура воды заменяется более
рыхлой структурой льда. Это происходит в отдельных немногочисленных точках (цен-
трах) кристаллизации, минимальный размер которых порядка 300–400 молекул воды.
Чем ниже температура кристаллизации воды, чем быстрее идёт охлаждение, тем больше
образуется кристаллов льда и тем меньше их размеры».
Главную опасность для икры при замерзании представляет характер кристаллизации
и количество замерзающей в ней воды. Обычно в клетке много «свободной» воды, и кри-
сталлизуется большая её часть, это и является причиной её гибели. Также показано, что
на разных стадиях и этапах развития устойчивость к переохлаждению различна: наибо-
лее устойчивыми являются самые ранние и самые поздние этапы эмбриогенеза (Лози-
на-Лозинский, 1972).
Исследования А. И. Любицкой (1940) по выявлению чувствительных к переохлажде-
нию стадий развивающейся икры окуня установили, что наиболее устойчивыми явля-
ются оплодотворенные яйца до дробления, в период дробления и на стадии бластулы.
Плохо переносит икра переохлаждение в начале бластулы и на стадии эмбриона с тремя
мозговыми пузырями. В конце этапа органогенеза устойчивость к переохлаждению вновь
увеличивается.
Де Фриз и его коллеги (De Vries et al., 1982) исследовали приспособленность ното-
тениевых рыб (Nototheniidae) к существованию в водах Антарктики при температурах,
снижающихся до –2,2° C. Ими было установлено, что у нототениевых рыб пролива
Мак-Мёрдо хлористый натрий и другие ионы и мелкие молекулы обеспечивают только
40–50% депрессии (т. е. снижения температуры замерзания воды) ниже 0° C, несмотря на
то что у антарктических рыб концентрация этих веществ несколько выше, по сравнению
с рыбами морских вод умеренных широт. Выяснилось, что низкая точка замерзания жид-
костей тканей антарктических рыб (?) обусловлена, главным образом, восемью биохими-
ческими соединениями — антифризами, обнаруженными у большинства нототениевых
рыб. Полный набор этих соединений содержится почти во всех жидкостях организма рыб
(кроме мочи и жидкости глаз) и по весу составляет 3,5% от общего веса жидкостей тела
(Истмен, Де Фриз, 1987).
Обнаруженные антифризы представляют собой гликопептиды, состоящие из повторя-
ющихся трех аминокислот (аланин-аланин-треонин) и дисахарида, ковалентно связанного
с третьей аминокислотой (треонином). Отличие этих антифризов заключается, главным
образом, в длине цепочки молекул. Самая крупная молекула имеет молекулярную массу
в 33700 дальтон, а самая короткая — 2600 дальтон. Установлено, что с увеличением мо-
лекулярной массы способность снижать точку замерзания возрастает. Эти соединения
оказывают антифризное действие не коллегативно, т. е. не за счет растворения состав-
ляющих молекулу частиц, а за счет адсорбции молекул на центрах кристаллизации, что
позволяет усилить антифризную активность в 200–300 раз по сравнению с растворами
той же концентрации, но лишенных гликопептидов. Вероятно, антифризная активность
158
гликопептидов связана с гидроксильными (ОН) и другими, «торчащими» в стороны от
«скелета» молекулы, полярными группами. Именно эти группы и связываются со льдом
(Истмен, Де Фриз,1987).
В икре сиговых рыб аналогичных антифризов не обнаружено, но высокое содержа-
ние белков, жиров и углеводов в желтке сиговых рыб и, особенно мукополисахаридов
в перивителлиновой жидкости, по нашему мнению, должно способствовать ее высокой
антифризной активности. Больше половины жировых включений в икре сиговых рыб
составляют холестерин и лецитин (Петренко,1977).
Уместно добавить наблюдения В. П. Серебрякова (1967), когда он обнаружил нор-
мально развивающиеся личинки трески в струях Лабрадорского течения при температуре
морской воды –1,75° C (Черняев, 2013). Никаких следов антифризов в телах личинок тре-
ски пока не обнаружено, вероятно, что антифризы и тресковых, и сиговых рыб строятся
на иной биохимической основе.
До определенного температурного предела икра сиговых рыб адаптирована к перене-
сению отрицательных температур путем авторегуляции. Для осуществления обратимо-
сти функций у икринок необходимо, чтобы структуры клеток и внеклеточное вещество
не разрушались под действием охлаждения, замораживания, дегидратации, оттаивания
и были способны восстанавливать нарушенное равновесие. В случае холодового анаби-
оза на биосистему действуют два противоположно направленных фактора: с одной сто-
роны, при усилении охлаждения увеличивается повреждаемость, а с другой, снижение
метаболизма приводит к повышению выживаемости.
С помощью электротермометра В. Д. Богдановым (2007) был прослежен темпера-
турный режим льда на нерестовой реке Манья в точках 0,5 и 0,8 м от его поверхности.
Установлено, что температура нижних слоев льда в течение зимы, при минимальной тем-
пературе воздуха –36?С и толщине снегового покрова 0,2 м, стабильно равна 0?С. В по-
верхностных слоях льда, имеющих более низкую температуру, икры сигов почти нет, так
как в шугоход икра сигов при нересте опускается и вмерзает в донный лед, который после
ледостава всплывает и смерзается со льдом поверхности реки. Кроме того, на многих си-
бирских реках увеличение толщины льда часто происходит за счет образования наледей.
Известно, что вода при температуре, близкой к точке замерзания, подвижна, как и при
более высокой температуре. Вследствие этого молекулы воды группируются вокруг ядер
кристаллизации, а основная среда не затрудняет происходящую при кристаллизации пе-
регруппировку молекул. В процессе кристаллизации воды ионы растворенных веществ
вытесняются, располагаясь за гранями образующихся кристаллов. В результате процесса
замерзания воды в кристаллическом льду остается очень небольшое от исходного коли-
чество солей, газов и других примесей (Одрова, 1976).
Исследования К. К. Вотинцева и Г. В. Овчаровой, проведенные в 1960 г. в лаборато-
рии гидрохимии Лимнологического института СО АН СССР, определили содержание
кислорода в метровом слое кристаллического прозрачного байкальского льда. В февра-
ле-марте в верхнем слое было обнаружено 3,9, в среднем слое 2,2 и в нижнем 3,7 мг/л,
в то время как до ледостава содержание кислорода в воде было порядка 12–14 мг/л
(Черняев, 1971; Tcherniaev, 1977). Эти данные согласуются с мнением В. Л. Цурикова
(1980), показавшим, что при образовании льда происходит вымораживание газов, солей
и мелких частиц в виде рассолов по каналам стока, пронизывающим всю толщу льда
и позже способствующим диффузии газов сквозь ледяной покров, как с границы атмос-
фера — лёд, так и с раздела лёд — вода. Тем не менее, диффузия газов через лёд имеет
место, но крайне замедлена.